El Reto Metástasis es un llamamiento del IRB Barcelona a toda la sociedad para combatir la metástasis. Queremos involucrar a ciudadanos, instituciones y empresas para recaudar 5 millones de euros que nos permitirán acelerar la investigación, captando nuevo talento, adquiriendo tecnología punta y habilitando nuevos espacios de laboratorio.
La metástasis es la expansión del cáncer a diferentes órganos del cuerpo. A pesar de los avances en investigación oncológica de los últimos años, la metástasis sigue siendo responsable del 90% de las muertes por cáncer. La metástasis es la expansión del cáncer a diferentes órganos del cuerpo. Conocemos bien los tumores y sabemos cómo tratarlos, pero nos queda aún mucho camino para diagnosticar, prevenir y curar la metástasis.
Descubre en el siguiente vídeo los avances que hemos realizado en investigación de metástasis
Qué es la metástasis
1. ¿Qué es la metástasis?
El cáncer es una enfermedad causada por errores, denominados “mutaciones”, en el material genético (es decir, en el ADN) de nuestras células. Si el cuerpo no es capaz de corregir estas mutaciones, se acumulan haciendo que las células se multipliquen de forma descontrolada y den lugar a tumores.
La metástasis es la expansión del cáncer desde el tumor primario (tumor original) a otros órganos vitales como el cerebro, el pulmón o el hígado, a través de los vasos sanguíneos o linfáticos. Los tumores primarios raramente son letales. En cambio, la metástasis es difícil de controlar.
La palabra “metástasis” se utiliza en el contexto de los tumores sólidos, es decir, aquellos que no se originan en las células de la sangre. Estos últimos reciben el nombre de "tumores líquidos". Los más comunes son las leucemias y los linfomas.
En las últimas décadas, la investigación centrada en el estado inicial de la enfermedad (tumor primario) ha permitido mejorar significativamente la supervivencia de los pacientes. Actualmente, gracias a los avances a nivel de técnicas quirúrgicas, tratamientos y protocolos de detección precoz, el 60% de los cánceres se curan o se cronifican.
Desgraciadamente, la metástasis no se comporta como los tumores primarios, lo que hace que las terapias disponibles no sean efectivas para tratar a la mayoría de los pacientes que la padecen. Por eso, es urgente idear nuevas estrategias para la prevención, diagnóstico y tratamiento de la metástasis.
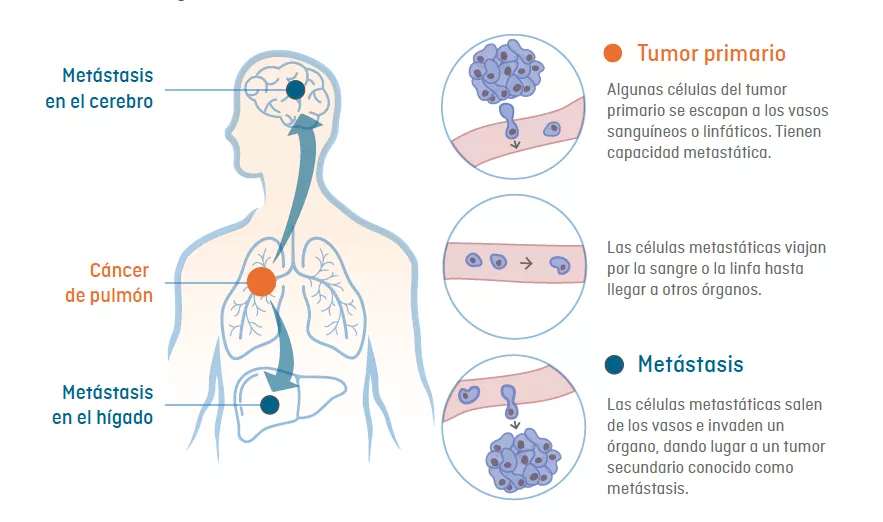
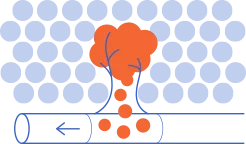
Como se muestra en la imagen superior, en las metástasis, las células cancerosas se separan del tumor primario para formar nuevos tumores en otras partes del cuerpo. Las células tumorales pueden viajar a través de los vasos linfáticos o sanguíneos cercanos al tumor primario, hasta llegar al órgano donde realizan metástasis.
2. ¿Cómo se desarrolla la metástasis?
La metástasis se origina a partir de células cancerosas que tienen la capacidad de migrar desde el tumor primario y llegar a otro órgano, donde se asientan y dan lugar a un nuevo tumor (metástasis).
Para que esto sea posible, estas células deben “viajar” siguiendo cuatro fases:
- Abandonar el tumor primario.
- Introducirse en el torrente sanguíneo o linfático.
- Sobrevivir mientras circulan por el cuerpo.
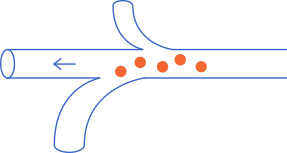
- Salir de la circulación y colonizar y adaptarse a las condiciones del órgano al que llegan, que son muy distintas a las de su órgano de origen. Este “viaje” se conoce como “cascada metastásica".
La mayoría de células que escapan del tumor no son capaces de sobrevivir en el torrente sanguíneo y/o linfático. Solo aquellas células que adquieren características (cambios en el material genético o ADN) ventajosas para sobrevivir fuera del tumor son capaces de colonizar otros órganos. Algunas de estas características son la baja multiplicación (que produce resistencia a la quimioterapia) y la capacidad de ser invisibles frente a las células del sistema inmunitario.
Desde el punto de vista terapéutico, entender cómo las células cancerosas adquieren la capacidad de abandonar el tumor primario y “viajar” es importante para prevenir las metástasis en pacientes diagnosticados con tumores primarios, mientras que entender las características adquiridas por las células que llegan al órgano secundario con éxito (colonización exitosa) puede conducir a terapias efectivas para los pacientes que ya tienen metástasis.

3. ¿Qué es la recaída del cáncer?
La recaída (también conocida como “recurrencia” o “recidiva”) es la reaparición del cáncer después de que el tumor primario haya sido eliminado mediante cirugía o quimioterapia y cuando la enfermedad ha sido indetectable durante un determinado período de tiempo. La recaída puede ser local (cuando el tumor vuelve a crecer en el sitio primario) o, más habitualmente, en forma de metástasis (el tumor crece en un órgano distante). Uno de los factores que explica la recurrencia es el hecho de que las células iniciadoras de la metástasis pueden entrar en un estado de latencia en el que no se multiplican. Esto las hace resistentes a la quimioterapia, la cual ataca principalmente a las células que proliferan
Las células metastásicas entran en “hibernación” (o en estado latente) porqué las condiciones físicas, metabólicas (disponibilidad de nutrientes, oxígeno, etc.) e inmunitarias del órgano colonizado (órgano huésped) dificultan su multiplicación. Se mantienen en este estado hasta que las condiciones del ambiente son favorables para generar un nuevo tumor.
En algunos casos, las células tumorales envían señales a las células residentes del órgano huésped para generar condiciones propicias, como la creación de nuevos vasos sanguíneos, a través de los cuales lleguen nutrientes y oxígeno para crecer. Al mismo tiempo, las células metastásicas pueden sufrir mutaciones (cambios en el material genético o ADN) que les confieren características beneficiosas para sobrevivir, como por ejemplo, convertirse en invisibles para el sistema inmunitario y evitar, así, ser detectadas y eliminadas.
En la mayoría de los casos, las células metastásicas pueden mantenerse latentes durante meses, años o incluso décadas, antes de formar una metástasis clínicamente detectable. Algunos tumores primarios tienen más probabilidades de desarrollar metástasis que otros (columna “tasa de recaída metastática” en la siguiente tabla), y el tiempo de aparición de estas metástasis varía en función del órgano en el que se origina el tumor primario (columna “intervalo de latencia” en la siguiente tabla):
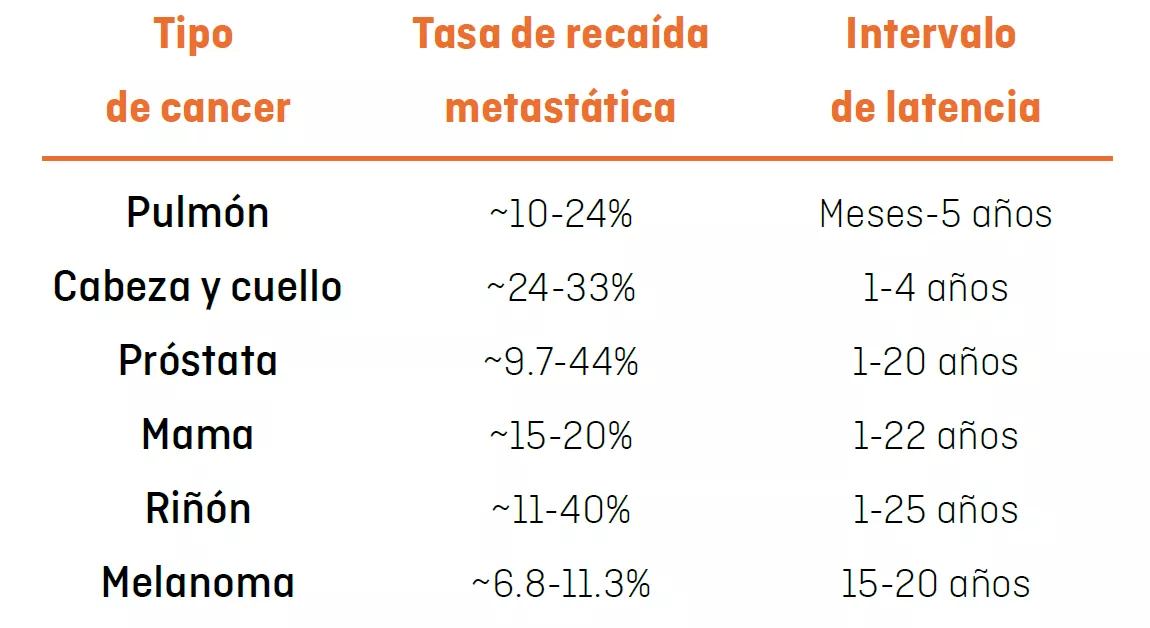
En la tabla de arriba se muestra la tasa de recaída metastásica e intervalo de latencia en pacientes con distintos tipos de cáncer. La tasa de recaída metastásica hace referencia al riesgo de tener una recaída después de eliminar el tumor primario y el intervalo de latencia hace referencia al período de tiempo en el que puede suceder la recaída. Tabla adaptada de Kim Márquez-Palencia & Malladi, Frente. Inmunol. (2019).
4. ¿En qué órganos forman metástasis los tumores?
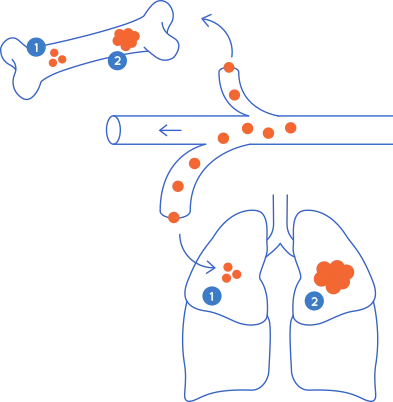
La metástasis se desarrollará en un órgano determinado dependiendo del tejido en el que se ha originado el cáncer. Es más probable que ciertos tipos de cáncer se diseminen a órganos concretos, lo que se llama "organotropismo metastásico". Por ejemplo, el cáncer de colon suele desarrollar metástasis en el hígado, porque el circuito que sigue la sangre que drena los intestinos fluye hacia el hígado a través de la vena porta hepática. Una vez generada la metástasis en el hígado, se puede producir una metástasis secundaria en los pulmones, hecho que se conoce como “metástasis secuencial”.
Las células de un mismo tipo de cáncer pueden ser más propensas a colonizar unos órganos u otros en función de sus propiedades. Un ejemplo son los diferentes subtipos de cáncer de mama: los tumores positivos para los receptores de estrógeno (ER+) son más propensos a formar metástasis en los huesos, mientras que los tumores ER tienden a ir a órganos como los pulmones, el hígado o el cerebro.
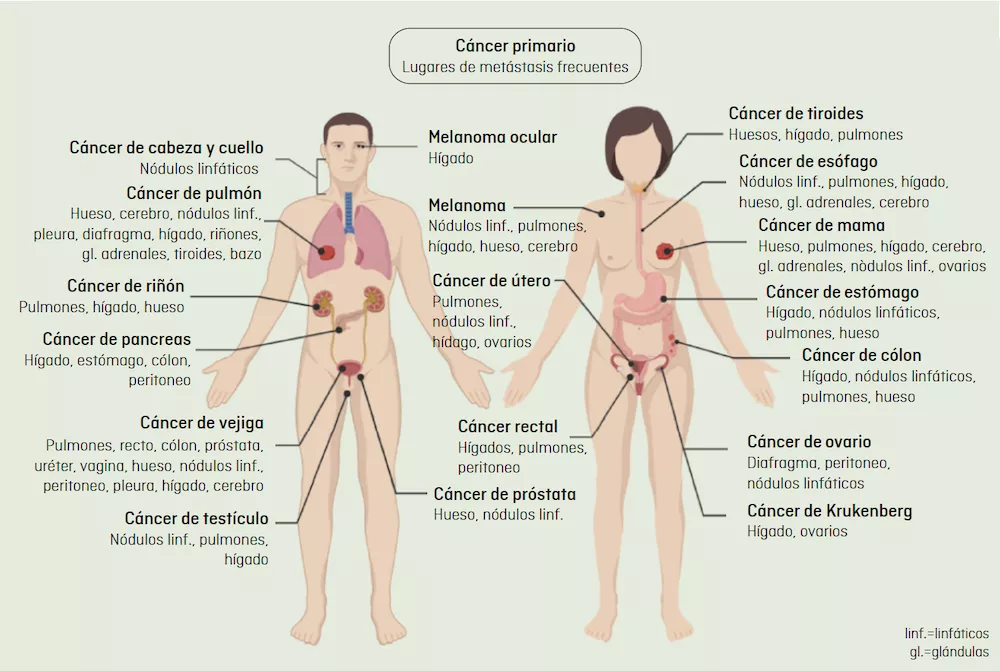
En la imagen de arriba se observan los trayectos habituales de la metástasis. Las observaciones clínicas sugieren que la mayoría de los cánceres realizan metástasis en órganos específicos, un proceso que se conoce como "organotropismo metastásico". Adaptación de Fares J. et al, Nature, 2020.
5. ¿Cómo se detecta la metástasis?
En las primeras fases de la metástasis, el número de células que logran sobrevivir es muy bajo. En la mayoría de casos, se trata de células aisladas o que se encuentran en pequeños grupos (“micrometástasis”), lo que dificulta mucho su detección por métodos de diagnóstico de imagen convencionales, como la tomografía por emisión de positrones (PET) o la resonancia magnética (RMN).
Los métodos de detección precoz tienen como objetivo encontrar las células tumorales antes de que lleguen al órgano en el que harán metástasis. Una práctica muy extendida es el análisis exhaustivo del ganglio linfático más cercano al tumor primario, llamado “ganglio centinela", al que es probable que el cáncer se disemine en primer lugar. En el caso de presentar células tumorales, este ganglio suele extirparse para actuar como “cortafuegos”.
Otros métodos tienen como objetivo detectar el rastro de células tumorales en circulación mediante muestras (biopsias) de la sangre. Se pueden realizar mediante la detección de señales (“biomarcadores”) específicos en la superficie de las células tumorales que las diferencian del resto de células de la sangre, o por medio de la detección de material genético (ADN) o vesículas (“exosomas”) circulantes procedentes de células tumorales.
En ambos casos, el bajo número de células presentes en los primeros estadios de la metástasis sigue siendo el principal obstáculo para el diagnóstico fiable de la enfermedad. Por este motivo, en los últimos años se están haciendo grandes esfuerzos por describir cómo son las células originarias de la metástasis y por mejorar la sensibilidad de los métodos de diagnóstico.
6. ¿Por qué es tan difícil de tratar la metástasis?
La mayoría de los medicamentos oncológicos no son efectivos en el tratamiento de la metástasis, a menudo debido a que las células metastásicas adquieren mecanismos de resistencia a la terapia. La inmunoterapia (técnica que mejora las células del sistema inmunitario del paciente) está emergiendo como una estrategia revolucionaria para la remisión o cronificación de algunos tipos de cáncer avanzado, pero, desgraciadamente, todavía no existen opciones efectivas para la mayoría de cánceres metástasicos.
A menudo, el propósito de los tratamientos de las metástasis es detener su crecimiento para evitar el avance de la enfermedad y conseguir cronificarla. Si el cáncer metastásico responde bien al tratamiento, algunas personas pueden llegar a vivir años después del diagnóstico inicial de la metástasis.
Los factores que contribuyen a que la metástasis sea difícil de eliminar son los siguientes:
- En muchos casos, la metástasis se desarrolla en órganos vitales, como los pulmones o el cerebro, lo que hace que generalmente no sea operable, ya que afectarían al funcionamiento del órgano afectado y pondrían en riesgo la vida del paciente.
- Las células metastásicas tienen características distintas a las células del tumor primario, el cual, en ciertos casos, les confiere resistencia a los tratamientos a los que las células del tumor primario eran sensibles. Estas características, que suelen ser ventajosas para la supervivencia de las células metastásicas, se adquieren a partir de mutaciones que se acumulan en el ADN.
- Las micrometástasis están formadas por una o varias células que, en muchos casos, se encuentran “dormidas” (latentes) hasta tener condiciones favorables para multiplicarse. Se trata de células individuales o grupos pequeños de células que son difíciles de detectar por las técnicas de diagnóstico de imagen convencionales (tomografía por emisión de positrones (PET), la resonancia magnética (RMN), etc., lo que las hace difíciles de detectar.
Uno de los retos actuales de la investigación biomédica es desarrollar métodos para la detección de las micrometástasis, así como entender mejor las debilidades de las células metastásicas para poder diseñar estrategias terapéuticas que permitan su eliminación.
7. ¿Qué hacemos en el IRB Barcelona para vencer la metástasis?
La metástasis no se comporta como los tumores primarios ni responde a los mismos tratamientos, lo que la convierte en una enfermedad extremadamente compleja. En el IRB Barcelona centramos nuestra experiencia multidisciplinar en el estudio de la metástasis para entender cómo se desarrolla y poder detenerla.
Nuestro objetivo es contribuir a dar respuesta a tres preguntas fundamentales:
- ¿Cómo podemos predecir el riesgo de recaída del cáncer?
- ¿Cómo prevenir la metástasis?
- ¿Cómo tratar la metástasis?
En el IRB Barcelona disponemos de 28 grupos de investigación en los que se agrupan más de 400 científicos especialistas en diferentes disciplinas. Cada uno de los 28 laboratorios cuenta con un equipo multidisciplinar donde biólogos, químicos, informáticos o médicos trabajan con la tecnología más avanzada en microscopía, secuenciación del genoma, bioinformática y síntesis de compuestos químicos.
Gracias a esta combinación tenemos la oportunidad de descubrir nuevas estrategias para el diagnóstico, la prevención o el tratamiento de la metástasis.

Los siguientes son algunos ejemplos de los resultados de nuestra investigación:
Una nueva herramienta para universalizar la medicina personalizada del cáncer
Durante el crecimiento de un tumor, las células cancerosas acumulan alteraciones (mutaciones) en su genoma. Nuestro laboratorio de Genómica Biomédica, liderado por la Dra. Núria López-Bigas, ha desarrollado una herramienta computacional (el “Cancer Genome Interpreter”, CGI) basada en el aprendizaje automático, que permite identificar cuáles de estas mutaciones son importantes para la progresión del tumor y cuáles de ellas pueden estar relacionadas con la respuesta a la terapia.
El CGI tiene por finalidad que el personal médico pueda pautar el tratamiento más adecuado para cada paciente. Actualmente, el IRB Barcelona colabora con diferentes entidades a nivel europeo (asociaciones de pacientes, hospitales y otros centros de investigación), con el objetivo de implementar esta herramienta de medicina personalizada en los sistemas de salud.

Un test para predecir el riesgo de metástasis ósea en pacientes de cáncer de mama
Aproximadamente 1 de cada 8 mujeres desarrollará cáncer de mama a lo largo de la vida y, en un 15% de estos casos, el cáncer se extenderá a los huesos. Aunque el cáncer de mama tiene un elevado porcentaje de supervivencia (de cerca del 85%), el pronóstico empeora considerablemente en los casos con metástasis.
El grupo de investigación de Control del Crecimiento y Metástasis del Cáncer, liderado por el Dr. Roger Gomis, ha identificado un gen (MAF) que es clave en el desarrollo y, más concretamente, en la diseminación, de las células cancerosas en los huesos. A partir de este descubrimiento, la empresa Inbiomotion, spin-off del IRB Barcelona fundada por el Dr. Gomis, ha creado un test (MAF test®) que predice la probabilidad que tiene un paciente de cáncer de mama de desarrollar metástasis en los huesos años después de haber padecido la enfermedad, determinando si esta persona podría beneficiarse de un tratamiento adyuvante (potenciador) de la quimioterapia para prevenir su recaída. Ahora se trabaja para que el MAF test® se incorpore a la práctica clínica y sea de uso común en los hospitales o centros médicos.

Fármacos que bloquean el consumo de grasas para tratar la metástasis
El laboratorio de Células Madre y Cáncer, dirigido por el Dr. Salvador Aznar-Benitah en el IRB Barcelona, ha descubierto que una proteína llamada CD36 es determinante para que las células cancerosas sean metastásicas.
CD36 se encuentra en las membranas de las células tumorales y se encarga de capturar e internalizar los ácidos grasos. Utilizando modelos animales de laboratorio, los investigadores han observado que cuando bloquean CD36 pueden prevenir la formación de la metástasis o reducir de forma drástica aquellas que ya están formadas. Estos resultados se han comprobado en diferentes tipos de carcinomas (orales, de mama, de pulmón, de ovario, de vejiga y melanoma) y demuestran que existe una relación directa entre el consumo de grasas (concretamente, de ácido palmítico) y la potenciación de la metástasis a través de CD36.
A raíz de estos resultados, el IRB Barcelona y la Institución de Investigación y Estudios Avanzados (ICREA) han fundado la empresa Ona Therapeutics, que se centra en descubrir medicamentos para el tratamiento del cáncer metastático.

Terapias experimentales basadas en inmunoterapia para el tratamiento del cáncer colorrectal avanzado
La inmunoterapia es una técnica que consiste en mejorar el sistema inmunitario para ayudar al cuerpo a eliminar las células cancerosas. Esta técnica se ha convertido en poco tiempo en un arma muy eficaz para tratar algunos tumores como el melanoma o el cáncer de pulmón. Sin embargo, la mayoría de los tumores de colon no responden a este tipo de tratamiento.
El laboratorio de Cáncer Colorrectal, liderado por el Dr. Eduard Batlle, ha descubierto que la hormona TGF-beta es la responsable de que el sistema inmunitario no reconozca ni elimine las células tumorales de colon. Utilizando modelos animales, el equipo investigador ha demostrado que la combinación de un anticuerpo que bloquea TGFbeta con inmunoterapias ya disponibles logra eliminar metástasis establecidas que de otro modo causarían la muerte.
El grupo del Dr. Batlle también ha identificado por primera vez a las células responsables de que el cáncer colorrectal reaparezca en forma de metástasis después de que el tumor primario haya sido operado. Estas células tumorales residuales, que se ocultan en el hígado y en el pulmón, son invisibles a los métodos de detección disponibles y pueden eliminarse mediante un tratamiento con inmunoterapia previo a la cirugía.
Estos descubrimientos abren vías para el desarrollo de nuevas terapias dirigidas específicamente a eliminar la enfermedad residual o avanzada, así como de nuevas herramientas diagnósticas para identificar a aquellos pacientes con mayor riesgo de recaída.
Degradación dirigida de proteínas como herramienta terapéutica
El grupo de Degradación Dirigida de Proteínas y Descubrimiento de Fármacos, dirigido por la Dra. Cristina Mayor-Ruiz, aplica la técnica de la eliminación (degradación) dirigida de proteínas al estudio molecular del cáncer y al descubrimiento de nuevos enfoques terapéuticos.
Actualmente, alrededor del 80% de todas las proteínas de nuestro cuerpo quedan fuera del alcance de los fármacos tradicionales. El objetivo del laboratorio de la Dra. Mayor-Ruiz es sistematizar el descubrimiento y generación de nuevos fármacos que degradan proteínas que contribuyen a la multiplicación de las células del cáncer, para ofrecer así nuevas oportunidades de tratamiento.

Para apoyar esta nueva línea de investigación, el IRB Barcelona ha puesto en funcionamiento una unidad de descubrimiento de fármacos (Plataforma de Cribado de Fármacos), en una apuesta clara por acelerar la llegada de la investigación a la práctica clínica.

El laboratorio de la Dra. Cristina Mayor-Ruiz es un claro ejemplo de nuevos laboratorios que están desarrollando proyectos en las áreas más prometedoras de la investigación oncológica. Este progreso ha sido posible gracias a la confianza de las personas y entidades que nos apoyan.
Descarga el ebook ‘Metástasis: preguntas y respuestas’
¿Quieres recibir el libro digital 'Metástasis: preguntas y respuestas'? Rellena el siguiente formulario.
Haz tu donación para el Reto Metástasis
3.168.886 €
Conseguido
5.000.000 €
Objetivo
¿Cuánto desgravan las donaciones?
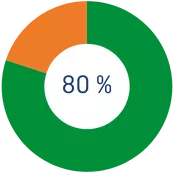
*Los primeros 250€ que dones tendrán una desgravación del 80%.
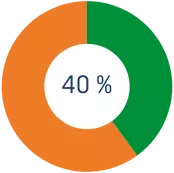
*Te desgravarás un 40% del importe que excede de los 250€.
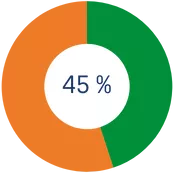
*Si es el 3r año o más que donas al IRB Barcelona con una cantidad igual o superior al año anterior, la desgravación por el importe que excede los primeros 250€ se incrementa al 45%.
Testimonios del Reto Metástasis
Pacientes
Otras formas de sumarte al Reto Metástasis
Organiza tu propia "Misión: Posible”
#RetoMetástasis
¿Eres deportista? ¿Haces manualidades? ¿Te casas? ¿Tu empresa, escuela o club hace una fiesta? ¿...y quieres contribuir a frenar la metástasis? Crea aquí tu campaña y ayúdanos a llegar muy lejos. Y, si aún estás dándole vueltas, puedes apoyar otras iniciativas que ya están en marcha.
Últimas noticias del Reto Metástasis
Colaboran con el Reto Metástasis