Images
Investigadores dirigidos por Maria Macias, investigadora ICREA del Instituto de Investigación Biomédica (IRB Barcelona) y por Joan Massagué, investigador Howard Hughes Medical Institute del Memorial Sloan-Kettering Cancer Center (MSKCC) de Nueva York, han identificado un nuevo mecanismo molecular que desempeña un papel crucial en el control de la activación de la transcripción de algunos genes asociados con el cáncer.
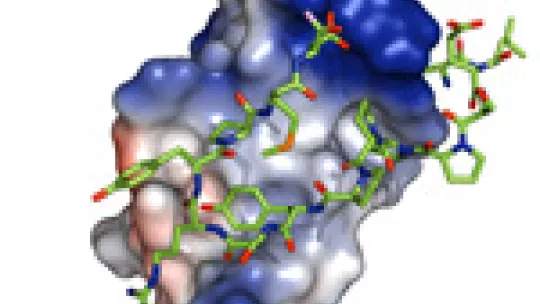
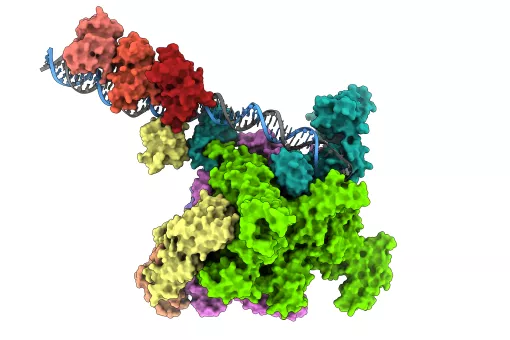
A través de detallados estudios estructurales y bioquímicos, los investigadores han podido identificar un dominio clave presente en la familia de proteínas llamada Smads, cuya unión determina si la transcripción de los genes controlados por las cascadas TGF-beta y BMP se unirán a activadores o serán etiquetadas para su degradación. Estos procesos son críticos para el correcto desarrollo y mantenimiento de los tejidos y organismos.
Al investigar los Smads-inhibidores, los investigadores encontraron que dicho dominio une de forma directa y constitutivamente a sus dianas. Esto contrasta con lo que ocurre con los Smads activados por receptor, en los que las proteínas deben someterse a procesamiento por fosforilación -una modificación química- por la que las proteínas son reconocidas por activadores o quedan marcadas para su degradación. El estudio se publica hoy (23 de Agosto) en la página web de la revista Structure.
Las proteínas Smads son clave en las vías de señalización de las hormonas TGF-beta y BMP, que participan en el control de la pluripotencialidad y diferenciación de las células madre y en el desarrollo y mantenimiento de los metazoos. En este estudio, los investigadores analizaron las interacciones de Smad7 - un inhibidor de la señalización por TGF-beta - con moléculas implicadas en las cascada, incluyendo tres ubiquitin ligasas y YAP, un coactivador de la transcripción. Identificaron los dominios en las cuatro proteínas que interactúan con la misma región de Smad7 y cuantificaron estas interacciones en forma de valores de afinidad.
Un trabajo previo de los grupos con los Smads activados por receptor ha mostrado que para que tenga lugar la transcripción, estos Smads son sometidos al proceso de fosforilación. En el estudio que se publica hoy -enfocado en los Smads inhibidores-, los investigadores descubren que este paso del procesamiento molecular no es necesario y que las cuatro proteínas unen constitutiva y directamente a sus dianas.
La ruta de TGF beta está regulada con precisión. Su regulación incluye un proceso de retroalimentación en el que los dos conjuntos de Smads mencionados desempeñan papeles complementarios en la misma cascada de señalización, ya que pueden tanto inhibir como activar la transcripción genética, dependiendo del tipo celular y de las necesidades fisiológicas del tejido u organismo. Como en la mayoría de los procesos biológicos, obtener un correcto equilibrio entre ambos es clave, ya que la transcripción genética descontrolada es característica de enfermedades serias como el cáncer. Este último descubrimiento ayuda a arrojar luz en la forma en que los organismos logran este equilibrio.
Una de las claves del éxito de este proyecto fue la combinación única de perspectivas y metodologías que los dos grupos aportaron. El equipo de Maria Macias utilizó una mezcla de técnicas de biología molecular y biofísica para descifrar las estructuras de subdominios dentro de las proteínas a nivel atómico. "El problema", explica, "es que estamos viendo pequeñas secciones de las proteínas completas aisladas de su entorno celular. Usando técnicas como la resonancia magnética nuclear somos capaces de ver los detalles de los sitios de unión hasta el nivel atómico. Pero debido a que nos fijamos tanto en los detalles, podemos perder de vista lo que estas interacciones significan para la función de la proteína entera en la célula.”
El equipo de Joan Massagué en el MSKCC, fue capaz de aplicar esta información detallada en un contexto general y, utilizando células de mamífero y proteínas completas, han podido observar los efectos que estos cambios tenían en la célula.
"Unir las imágenes detalladas con el contexto global es un paso difícil pero clave para entender la naturaleza de los procesos biológicos y para identificar qué ocurre en las enfermedades", explica Massagué, "La información detallada sobre las estructuras de las moléculas que participan en los procesos fundamentales, como la proporcionada por este estudio, nos puede decir dónde buscar para tomar el control cuando las cosas van mal.”
Artículo de referencia:
Structural basis for the versatile interactions of Smad7 with regulator WW domains in TGF-β pathways.
Aragón E, Goerner N, Xi Q, Gomes T, Gao S, Massagué J and Macias MJ.
Structure (August 23, 2012), http://dx.doi.org/10.1016/j.str.2012.07.014
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).