Images
Dos estudios del IRB Barcelona y el IBMB-CSIC, publicados en Nature Communications, descubren la estructura del portal del virus de Epstein-Barr y del bacteriófago T7.
En la actualidad no existe tratamiento para las infecciones causadas por el virus de Epstein-Barr que, además de causar mononucleosis, provoca varios tipos de cáncer.
Los estudios son una colaboración con el CNB-CSIC y la Universidad de Oxford.
Investigadores del Instituto de Investigación Biomédica (IRB Barcelona) y del Instituto de Biología Molecular de Barcelona (IBMB-CSIC) han publicado en la revista Nature Communications la estructura de una proteína esencial para el proceso de infección del virus de Epstein-Barr conocida como portal.
El virus de Epstein-Barr, perteneciente a la familia de los herpesvirus, es uno de los virus humanos más comunes y la principal causa de la mononucleosis infecciosa (conocida como enfermedad del beso), además de provocar diversos tipos de cáncer como los linfomas de Burkitt y Hodgkins, cáncer gástrico y cáncer nasofaríngeo, así como varias enfermedades autoinmunes. En la actualidad no existe tratamiento para las infecciones producidas por este virus.
“Conocer la estructura de la proteína portal podría ser útil para el diseño de inhibidores que puedan ser utilizados para el tratamiento de infecciones por herpesvirus, como el de Epstein-Barr. Además, al tratarse de una proteína exclusiva de herpesvirus, estos inhibidores serían específicos contra el virus y quizás menos tóxicos para los humanos”, comenta Miquel Coll, jefe del Laboratorio de Biología Estructural de Complejos de Proteínas y Ácidos Nucleicos y Máquinas Moleculares del IRB Barcleona y profesor del CSIC.
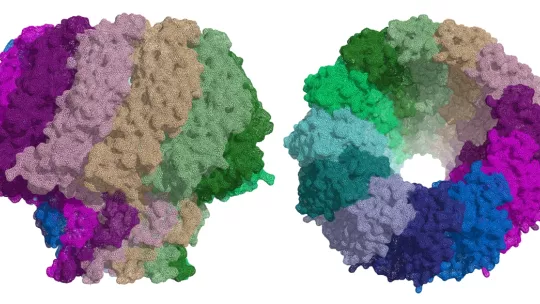
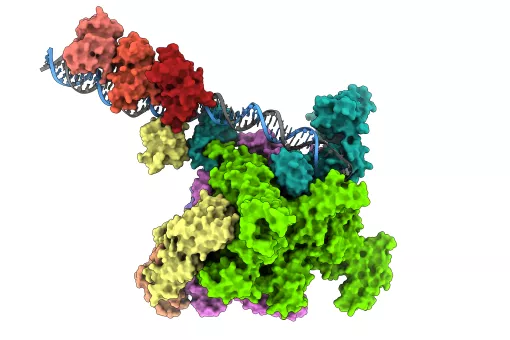
Todos los herpesvirus tienen un sistema de infección similar: una vez entran en el interior celular y alcanzan el núcleo, los virus liberan su ADN, que puede esconderse latente durante años hasta que, ante determinadas circunstancias, se desencadena su multiplicación. El ADN es replicado y posteriormente introducido en nuevas cápsides virales, para así formar nuevos virus que atacarán otras células. La proteína portal es el canal por donde el ADN entra en la cápside del virus y por donde sale al infectar las células.
En un segundo trabajo publicado recientemente en la misma revista, los investigadores han caracterizado también la estructura de la proteína portal en el bacteriófago T7. El bacteriófago T7 es un virus que infecta exclusivamente a bacterias y, curiosamente, utiliza un sistema muy parecido al de los herpesvirus para el empaquetamiento de su ADN.
“Gracias a la estructura de la proteína portal del bacteriófago T7 hemos podido inferir como funcionaría la de Epstein-Barr” explican Cristina Machón y Montserrat Fàbrega investigadoras postdoctorales del IRB Barcelona y del IBMB-CSIC y primeras autoras -junto con Ana Cuervo, del Centro Nacional de Biotecnología (CNB-CSIC)- de los trabajos publicados.
“En ambos virus, la proteína portal está compuesta por 12 subunidades, formando una gran estructura en forma de champiñón, con un canal central por el que pasa el ADN. Este canal presenta una válvula que regula la entrada y salida del material genético del virus” explica Coll.
Para estudiar la estructura de esta proteína, los investigadores utilizaron, tanto técnicas de difracción de rayos X de sincrotrón, como criomicroscopía electrónica de alta resolución. Ambos estudios fueron llevados a cabo en colaboración con el CNB-CSIC y la Universidad de Oxford (Reino Unido).
Los estudios han contado con financiación del programa de excelencia “Severo Ochoa” y “María de Maeztu”, el programa “Ramón y Cajal” del Ministerio de Ciencia, Innovación y Universidades, y los proyectos europeos iNEXT y Instruct-ERIC.
Artículos de referencia:
Cristina Machón, Montserrat Fàbrega-Ferrer, Daming Zhou, Ana Cuervo, José L. Carrascosa, David I. Stuart and Miquel Coll
Atomic structure of the Epstein-Barr virus portal
Nature Communications (2019) DOI: 10.1038/s41467-019-11706-8
Ana Cuervo, Montserrat Fàbrega-Ferrer, Cristina Machón, José Javier Conesa, Francisco José Javier Fernández, Rosa Pérez-Luque, Mar Pérez-Ruiz, Joan Pous, María Cristina Vega, José L. Carrascosa and Miquel Coll
Structures of T7 bacteriophage portal and tail suggest a viral DNA retention and ejection mechanism
Nature Communications (2019) DOI: 10.1038/s41467-019-11705-9
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).