Images
Dos estudis de l'IRB Barcelona i de l'IBMB-CSIC publicats a Nature Communications descobreixen l'estructura del portal del virus d'Epstein-Barr i del bacteriòfag T7.
En l'actualitat no existeix cap tractament per a les infeccions causades pel virus d'Epstein-Barr que, a més de causar mononucleosi, provoquen diversos tipus de càncer.
Els estudis són el resultat d’una col·laboració amb el CNB-CSIC i la Universitat d'Oxford.
Investigadors de l'Institut de Recerca Biomèdica (IRB Barcelona) i de l'Institut de Biologia Molecular de Barcelona (IBMB-CSIC) han publicat a la revista Nature Communications l'estructura d'una proteïna que és essencial per al procés d'infecció del virus d'Epstein-Barr, coneguda com a portal.
El virus d'Epstein-Barr, pertanyent a la família dels herpesvirus, és un dels virus humans més comuns i la principal causa de mononucleosi infecciosa (coneguda com a malaltia del petó), a més de provocar diversos tipus de càncer, com els limfomes de Burkitt i Hodgkins, el càncer gàstric i el càncer nasofaringi, així com diverses malalties autoimmunes. En l'actualitat no existeix cap tractament per a les infeccions produïdes per aquest virus.
“Conèixer l'estructura de la proteïna portal podria ser útil per al disseny d'inhibidors que puguin ser utilitzats per al tractament d'infeccions per herpesvirus, com el d'Epstein-Barr. A més, en tractar-se d'una proteïna exclusiva d'herpesvirus, aquests inhibidors serien específics contra el virus i potser menys tòxics per als humans”, explica el Miquel Coll, cap del Laboratori de Biologia Estructural de Complexos de Proteïnes i Àcids Nucleics i Màquines Moleculars de l'IRB Barcelona i professor del CSIC.
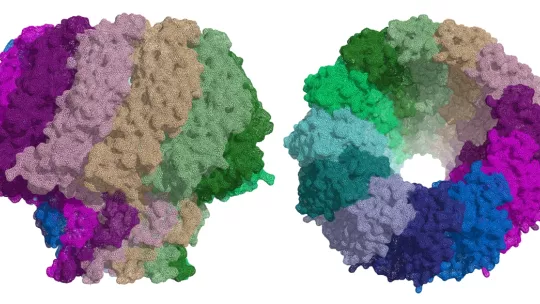
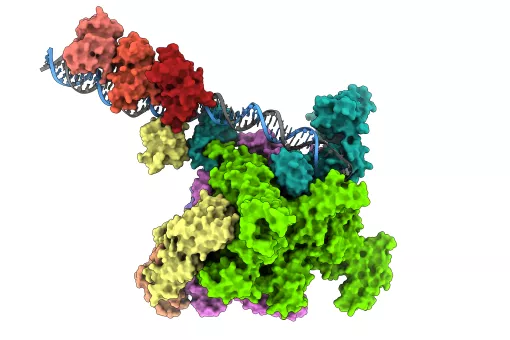
Tots els herpesvirus tenen un sistema d'infecció similar: un cop entren a l'interior de la cèl·lula i arriben al seu nucli, els virus alliberen el seu ADN, que pot amagar-se i restar latent durant anys, fins que, en determinades circumstàncies, se’n desencadena la multiplicació. L'ADN és replicat i posteriorment introduït en noves càpsides virals, per així formar nous virus que atacaran altres cèl·lules. La proteïna portal és el canal a través del qual l'ADN entra a la càpsida del virus i també a través del qual surt en infectar les cèl·lules.
En un segon treball publicat recentment a la mateixa revista, els investigadors han caracteritzat també l'estructura de la proteïna portal en el bacteriòfag T7. El bacteriòfag T7 és un virus que infecta exclusivament a bacteris i que, curiosament, utilitza un sistema molt semblant al dels herpesvirus per a l'empaquetament del seu ADN.
“Gràcies a l'estructura de la proteïna portal del bacteriòfag T7 hem pogut inferir com funcionaria la d'Epstein-Barr”, expliquen la Cristina Machón i la Montserrat Fàbrega, investigadores postdoctorals de l'IRB Barcelona i de l'IBMB-CSIC i primeres autores -juntament amb l’Ana Cuervo, del Centre Nacional de Biotecnologia (CNB-CSIC)- dels treballs publicats.
“En tots dos virus, la proteïna portal es composa de 12 subunitats que formen una gran estructura que recorda la forma d’un bolet, amb un canal central pel qual passa l'ADN. Aquest canal presenta una vàlvula que regula l'entrada i sortida del material genètic del virus”, explica Coll.
Per estudiar l'estructura d'aquesta proteïna, els investigadors van utilitzar tant tècniques de difracció de raigs X de sincrotró, com criomicroscòpia electrònica d'alta resolució. Tots dos estudis van ser realitzats en col·laboració amb el CNB-CSIC i la Universitat d'Oxford (Regne Unit).
Els estudis han comptat amb finançament dels programes d'excel·lència "Severo Ochoa" i “María de Maeztu”, el programa “Ramón y Cajal” del Ministeri de Ciència, Innovació i Universitats, i els projectes europeus iNEXT i Instruct-ERIC.
Artícles de referència:
Cristina Machón, Montserrat Fàbrega-Ferrer, Daming Zhou, Ana Cuervo, José L. Carrascosa, David I. Stuart and Miquel Coll
Atomic structure of the Epstein-Barr virus portal
Nature Communications (2019) DOI: 10.1038/s41467-019-11706-8
Ana Cuervo, Montserrat Fàbrega-Ferrer, Cristina Machón, José Javier Conesa, Francisco José Javier Fernández, Rosa Pérez-Luque, Mar Pérez-Ruiz, Joan Pous, María Cristina Vega, José L. Carrascosa and Miquel Coll
Structures of T7 bacteriophage portal and tail suggest a viral DNA retention and ejection mechanism
Nature Communications (2019) DOI: 10.1038/s41467-019-11705-9
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).