Images
Investigadors liderats per Natàlia Carulla troben els assemblatges específics de proteïna beta-amiloide (Aß), que tenen la capacitat de pertorbar la membrana de les neurones, causant la seva mort.
Els resultats han estat publicats a la revista Nature Communications.
El cervell de milions de persones que pateixen la malaltia d'Alzheimer s'està buidant lenta i inevitablement de neurones, el que condueix a les característiques pèrdua de memòria i de funció cognitiva, associades a aquesta malaltia. No obstant això, la causa de la mort neuronal encara es desconeix. Els tractaments disponibles tenen com a objectiu retardar el desenvolupament de la demència i només contribueixen a millorar la qualitat de vida en períodes de temps curts. Per tant, els tractaments per curar l'Alzheimer són una necessitat mèdica no resolta.
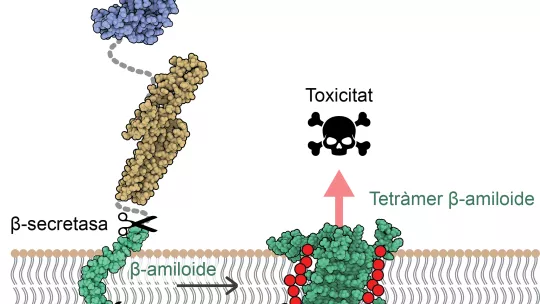
Investigadors liderats per Natàlia Carulla, alumni de l’IRB Barcelona, anteriorment cap de laboratori a l'Institut Européen de Chimie et Biologie (IECB) a Bordeus, i actualment responsable de projectes a Grup CIEF, han revelat per primera vegada l'estructura atòmica dels assemblatges de proteïnes beta-amiloide (Aß). El coneixement d'aquesta estructura revela un nou mecanisme de toxicitat per a aquests assemblatges, que tenen la capacitat d'alterar la membrana neuronal, permetent que l'aigua i els ions passin a través d'ella i causant la mort d'aquestes cèl·lules. Diversos estudis han proposat amb anterioritat que la interacció de la proteïna Aß amb la membrana neuronal és responsable de la mort neuronal observada en l'Alzheimer. No obstant això, la proteïna Aß és un objectiu terapèutic difícil, perquè és "enganxosa" i s’autoensambla, adoptant formes i mides diferents.
"Conèixer les característiques d'aquests conjunts de proteïnes, com la quantitat de molècules que els constitueixen i la forma que adopten, és crucial per dissenyar estratègies terapèutiques efectives que es dirigeixin als acoblaments d’Aß responsables de la neurotoxicitat en l'Alzheimer", explica Carulla.
Una aproximació in vitro per garantir formes estables d’Aß
Per abordar la inestabilitat de les diferents conformacions, l'equip primer va estudiar la proteïna Aß in vitro, en sistemes model simplificats que imiten la membrana neuronal, per obtenir acoblaments de Aß estables, amb composició i forma uniformes. Una vegada que es van identificar les diferents composicions, van estudiar la seva estructura i forma de neurotoxicitat, establint una disposició 3D de tots els àtoms que formen el conjunt Aß.
"El nostre estudi suggereix que alguns assemblatges d’Aß poden perforar la membrana de les neurones, alterar el seu equilibri osmòtic i, en conseqüència, desencadenar la seva mort", expliquen Sonia Ciudad i Eduard Puig, primers autors de l'article. Ciudad és alumni de l'IRB Barcelona, actualment científica d’R+D a Biokit, una empresa del grup Werfen, mentre que Puig actualment és investigador postdoctoral al Laboratori de Síntesi Asimètrica de l'IRB Barcelona.
Els porus de la membrana com a objectiu per evitar la neurotoxicitat
Aquest estudi ha destacat dos assemblatges de proteïnes Aß, un format per quatre proteïnes Aß i l'altre per vuit, on l'estructura té la capacitat d'alterar la membrana cel·lular, assenyalant-los com a possibles responsables de causar neurodegeneració en l'Alzheimer.
El treball en endavant s'hauria de centrar en prevenir la formació d'aquest conjunt, evitant així la ruptura de la membrana. En l'actualitat, els projectes en marxa sobre el descobriment de fàrmacs en aquest camp no inclouen cap fàrmac dirigit a aquests assemblatges d’Aß, de manera que aquesta troballa podria aconseguir un avanç significatiu en el tractament de la malaltia d'Alzheimer.
Aquest treball va ser finançat pel MINECO (SAF2015-68789), la Fundació La Marató de TV3 (20.140.730), la Fondation Recherche Médicale (AJE20151234751) i el Counseil Régional d’Aquitaine Limousin Poitou-Charentes (1R30117-00007559). Es va dur a terme en col·laboració amb el laboratori de Vladislav Orekhov al Swedish NMR Centre, University of Gothenburg, Benjamin Bardiaux a l'Institut Pasteur, Stéphane Chaignepain en CBMN, el laboratori de Sarah Cianferani a la Universitat d'Estrasburg, el laboratori de Giovanni Maglia en el Groningen Biomolecular Sciences & Biotechnology Institute i el laboratori d'Emad Tajkhorshid al NIH Center for Macromolecular Modeling and Bioinformatics.
Artículo de referencia:
Sonia Ciudad, Eduard Puig, Thomas Botzanowski, Moeen Meigooni, Andres S. Arango, Jimmy Do, Maxim Mayzel, Mariam Bayoumi, Stéphane Chaignepain, Giovanni Maglia, Sarah Cianferani, Vladislav Orekhov, Emad Tajkhorshid, Benjamin Bardiaux & Natàlia Carulla.
Aβ(1-42) tetramer and octamer structures reveal edge conductivity pores as a mechanism for membrane damage
Nature Communications (2020) DOI:10.1038/s41467-020-16566-1
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).