Images
- La proteïna p38a, que s'associa amb el càncer i altres malalties, adopta una estructura fins ara desconeguda regulada per condicions redox cel·lulars.
- El descobriment pot tenir implicacions a l'hora de dissenyar nous fàrmacs per bloquejar-la.
- El treball desenvolupat per l'IRB Barcelona en col·laboració amb la Universitat de Barcelona i l'empresa Nostrum Biodiscovery ha estat publicat a la revista Nature Communications.
La proteïna p38a, un enzim clau en la regulació de diferents funcions cel·lulars, juga un paper crucial en algunes malalties com el càncer, la inflamació crònica o les malalties neurodegeneratives. Des del seu descobriment, diverses companyies farmacèutiques i nombrosos grups de recerca han dedicat esforços considerables al desenvolupament de molècules destinades a inhibir aquesta proteïna, no obstant això, els resultats no han complit les expectatives per a poder desenvolupar fàrmacs.
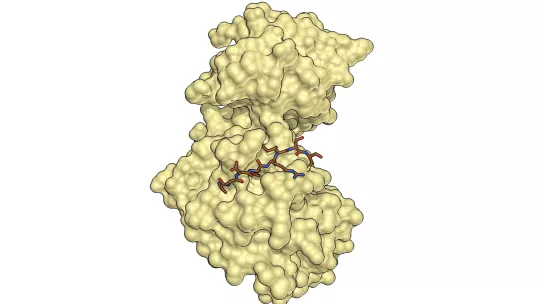
Un equip científic liderat per la Dra. Maria Macias i el Dr. Angel R. Nebreda, tots dos investigadors ICREA de l'IRB Barcelona, ha descobert que la proteïna p38a adopta una conformació no descrita amb anterioritat. Concretament, els investigadors han descobert una nova forma "oxidada", que la proteïna adoptaria de manera transitòria segons l'estat redox de la cèl·lula, en la qual s'estableix un pont disulfur. Aquesta nova forma de p38a, que s'ha descrit a la revista Nature Communications, no permet la unió amb activadors ni amb substrats, i per això no és capaç de realitzar les funcions característiques d'aquesta quinasa. Es tracta d'un procés reversible, i la funció de la proteïna es recupera en condicions reductores.
"La identificació d'una nova forma de p38a podria explicar les dificultats prèvies en el disseny d'inhibidors efectius de la p38a, ja que fins ara els estudis s'havien centrat en les conformacions reduïdes. Els nostres resultats obren noves vies per al desenvolupament de compostos terapèutics que modulin l'activitat de p38a de manera més precisa", explica la Dra. Macias, investigadora ICREA i cap del laboratori de Caracterització Estructural de Conjunts Macromoleculars de l'IRB Barcelona.
Una forma oxidada i una forma reduïda
Hi ha publicades 357 estructures de la proteïna p38a, a la base de dades de Protein Data Bank, però totes corresponen a la seva forma reduïda, l'única coneguda fins ara. Això es deu, possiblement, a la prevalença de condicions experimentals que inclouen la presència d'agents reductors en els estudis estructurals realitzats.
En la forma oxidada que descriu aquest estudi, s'estableix un pont disulfur que força un canvi de conformació que bloqueja l'accés al punt d'unió d'activadors i substrats. Així doncs, aquesta és una nova forma inactiva de la proteïna p38a, que estaria present en determinades condicions cel·lulars.
"L'estudi de quinases en la seva forma oxidada resulta complex a causa de la influència de condicions d'estrès oxidatiu i la transitorietat d'aquestes formes en l'entorn cel·lular", expliquen el Dr. Joan Pous, el Dr. Pau Martín Malpartida i l'estudiant de doctorat Blazej Baginski, primers autors del treball. "No obstant això, en elles pot residir la clau per abordar-les de manera efectiva des d'un punt de vista farmacològic", conclouen.
Un enfocament prometedor
Aquesta nova forma il·lustra un mecanisme d'acció de p38a regulat per l'estat redox cel·lular, explicant observacions bioquímiques descrites fins ara però sense base molecular estructural.
En futurs treballs, els investigadors se centraran a explorar noves cavitats d'interacció que apareixen en la forma oxidada, ja que poden ajudar a inactivar la proteïna sense intervenir en el centre catalític, guanyant així especificitat.
El treball ha estat desenvolupat en col·laboració amb el laboratori del Dr. Modesto Orozco a l'IRB Barcelona i la Universitat de Barcelona, i amb Nostrum Biodiscovery. El treball ha obtingut finançament del Ministeri de Ciència i Innovació (MICINN), del Consell Europeu de Recerca (ERC), de l'Agència de Gestió d'Ajuts Universitaris i de Recerca de Catalunya (AGAUR) i de la Fundació BBVA.

PID2022-136646OB-I00 financed by MCIN/AEI/10.13039/501100011033/ FEDER, UE
Article relacionat:
Structural basis of a redox-dependent conformational switch that regulates the stress kinase p38α
Joan Pous#, Blazej Baginski#, Pau Martin-Malpartida#, Lorena González, Margherita Scarpa, Eric Aragon, Lidia Ruiz, Rebeca A. Mees, Javier Iglesias-Fernández, Modesto Orozco, Angel R. Nebreda* & Maria J. Macias*
Nature Communications (2023) DOI: 10.1038/s41467-023-43763-5
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).