Images
Els resultats es publiquen a la revista científica PLoS One
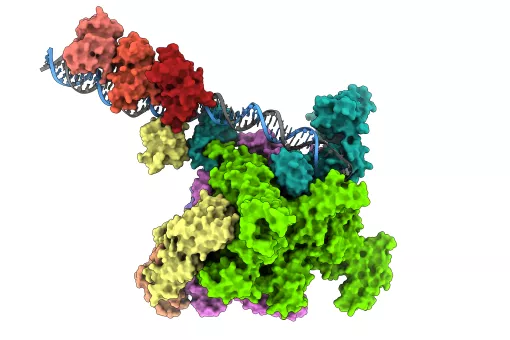
La majoria de funcions que du a terme una cèl·lula són fruit de les interaccions entre proteïnes, que es reconeixen com a parella per trets d’afinitat localitzats en la superfície. D’interaccions n’hi ha de diversa mena, però les més complicades d’abordar des de la biologia estructural són les transitòries. En aquest tipus de relacions fugaces, la interacció es produeix a través d’un tram gran de superfície d’una proteïna –el domini globular-, i un tram molt petit de la superfície d’una altra proteïna, anomenat motiu lineal o pèptid. La dificultat rau, precisament, perquè són relacions de curta durada i hi ha poques estructures de pèptids cristal·litzades. Investigadors de l’Institut de Recerca Biomèdica (IRB Barcelona) han dut a terme el primer anàlisi computacional d’interaccions transitòries entre proteïnes per esbrinar què determina que es reconeguin com a parella ideal i han revelat part dels mecanismes moleculars que intervenen en l’especificitat d’aquesta unió. La revista científica PLoS One n’ha recollit els resultats.
"Saber què determina els aparellaments entre proteïnes pot tenir implicacions, per exemple, en el disseny de nous medicaments", apunta Patrick Aloy, professor de recerca ICREA a l’IRB Barcelona, "però, ara per ara, en sabem molt poc encara sobre aquests tipus d’unions". Els unions transitòries es donen principalment entre proteïnes que intervenen en vies de senyalització i xarxes de regulació, i la seva funció es traduir i fer arribar els senyals des l’exterior de la cèl·lula fins al seu nucli.
El context importa
En el laboratori de Bioinformàtica Estructural de Patrick Aloy, han detectat tots els casos d’interaccions possibles entre domini globular i pèptid a través de l’exploració de les 45.000 estructures 3D de proteïnes que hi ha avui disponibles a la base de dades internacional PDB (Protein Data Bank), i n’han extret les regles. "Una de les conclusions de l’estudi ens diu que el què determina que dues proteïnes es reconeguin com a parella està fora del motiu lineal de contacte, en el què denominem context", explica Aloy. Els residus de context són aminoàcids que es troben en regions properes al motiu lineal, però no en formen part. "La força amb la que s’uneixen dues proteïnes sí que ve determinada pels contactes que es troben en el motiu lineal, però són els residus de context els que contenen la informació sobre la proteïna més convenient, alhora que eviten unions no desitjables amb proteïnes molt semblants", explica Amelie Stein, estudiant predoctoral al laboratori d’Aloy i primera signant de l’article.
L’anàlisi dels investigadors també ha revelat que en determinades condicions es poden donar interaccions no natives, és a dir, amb d’altres proteïnes que no serien les òptimes. "És el que anomenem parelles complementàries, altres proteïnes d’interacció que poden compensar la falta de la proteïna ideal", apunta Stein. Segons els investigadors, aquestes interaccions no òptimes permeten establir circuits d’emergència que incrementen la solidesa de les xarxes cel·lulars. Precisament, una línea d’estudi d’Aloy i Stein derivada d’aquest treball, es basa en identificar aquelles proteïnes incapaces d’establir circuits de seguretat i, per tant, amb bones possibilitats per esdevenir futures dianes terapèutiques.
Article de referència
Contextual specificity in peptide-mediated protein interaction
Amelie Stein and Patrick Aloy
PLoS One, e-pub ahead of print (2008); http://www.plosone.org/doi/pone.0002524
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).