Images
- Les cèl·lules amb major capacitat per a formar tumors es caracteritzen per tenir estats epigenètics aberrants que els permeten una major comunicació amb les cèl·lules del seu entorn.
- Realitzat en ratolins, l'estudi descriu les bases moleculars de la plasticitat cel·lular responsable de l'inici de la tumorigènesi induïda per l'oncogen KRAS i la inflamació tissular, i obre la via a nous enfocaments terapèutics.
- El treball ha estat publicat a la revista Science i co-liderat per la Dra. Direna Alonso-Curbelo de l'IRB Barcelona juntament amb investigadors del Memorial Sloan Kettering Cancer Center de Nova York.
Les mutacions en l'ADN són causes conegudes i ben estudiades del càncer. En concret, les mutacions en l'oncogen KRAS són freqüents en el càncer de pulmó, el càncer colorectal i el càncer de pàncrees.
No obstant això, les mutacions només expliquen una part del desenvolupament de la malaltia.
Segons un estudi publicat a la revista Science per investigadors del Memorial Sloan Ketterin Cancer Centre (MSKCC) de Nova York i la Dra. Direna Alonso-Curbelo, de l'IIRB Barcelona, les interaccions entre les mutacions genètiques i altres factors externs com, per exemple, una lesió tissular que provoqui inflamació, modifiquen tant la identitat de les cèl·lules com el seu entorn local i afavoreixen l'aparició i progressió de tumors.

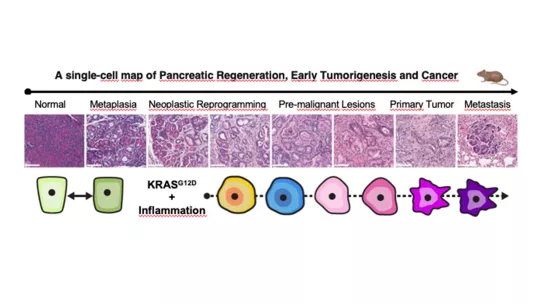
En el càncer de pàncrees, aquests canvis comencen a produir-se ràpidament, entre 24 i 48 hores després d'un dany tissular, i ocorren de manera previsible. Com a conseqüència, la capacitat d'algunes cèl·lules amb KRAS mutat per comunicar-se i interactuar amb altres cèl·lules del seu entorn augmenta enormement. Aquests són els resultats d’un nou estudi publicat a Science, que va combinar sofisticats models de ratolí genèticament modificats i mètodes computacionals avançats per mapejar els diferents estats cel·lulars que condueixen al desenvolupament de l'adenocarcinoma ductal pancreàtic (PDAC), el tipus més comú de càncer de pàncrees.
Tot i que la taxa de supervivència a cinc anys del càncer de pàncrees ha augmentat en els últims anys, continua sent molt baixa, al voltant del 12%, segons la Pancreatic Cancer Action Network. La malaltia sovint no es detecta fins que el càncer es troba en fases avançades i, gràcies en part als avenços en el tractament d'altres tipus de tumors, el càncer de pàncrees és avui en dia la tercera causa de mort per càncer.
L'objectiu de la investigació era, d'una banda, llançar llum sobre els esdeveniments cel·lulars inicials difícils d'estudiar, que donen lloc al càncer de pàncrees per trobar possibles oportunitats d'intervenció mèdica en fases més primerenques de la malaltia.
Com la plasticitat cel·lular impulsa el càncer
La capacitat de les cèl·lules per desprendre's de la seva identitat original i adaptar-se rep el nom de plasticitat. L'equip investigador va descobrir que la inflamació potencia aquesta plasticitat.

"Aquestes cèl·lules precanceroses adquireixen la capacitat d'enviar i rebre molts més senyals que una cèl·lula normal", explica la doctora en biologia computacional Dana Pe'er, una de les dues autores principals de l'estudi. "I vam veure que això no és aleatori: està estructurat. S'observen els mateixos patrons una vegada i una altra quan es realitzen experiments en diferents ratolins".
L'estudi va ser liderat per les co-primers autores, Cassandra Burdziak, estudiant de doctorat en el laboratori de la Dra. Pe'er (MSK), i la Dra. Direna Alonso-Curbelo, anteriorment investigadora al laboratori del co-autor principal, el Dr. Scott Lowe (MSKCC), i ara cap de laboratori a l'IRB Barcelona.
Amb l’objectiu d'estudiar els orígens i els impactes de la plasticitat en les cèl·lules que tenen mutacions en KRAS, els científics van realitzar anàlisis de cèl·lula individual en teixits normals, inflamats, premalignes i malignes utilitzant models de ratolí genèticament modificats que recapitulen amb precisió molts aspectes del càncer de pàncrees en humans, des del seu inici fins a la metàstasi.

"Aquests models ens van permetre captar els canvis més primerencs en les cèl·lules epitelials pancreàtiques a mesura que es reprogramen d'un estat sa a un estat maligne", explica el Dr. Lowe, investigador de l'Institut Mèdic Howard Hughes i director del Programa de Biologia i Genètica del Càncer del Memorial Sloan Kettering Cancer Center (MSKCC) de Nova York.
Les anàlisis de cèl·lula individual van permetre als investigadors desxifrar les característiques de les subpoblacions de cèl·lules individuals del pàncrees en cada fase de la progressió i com les seves interaccions impulsen encara més la progressió.
"Aquest projecte va requerir una quantitat significativa d'innovació experimental i computacional", assenyala la Dra. Pe'er, que també és investigadora de l'Institut Mèdic Howard Hughes i directora del Programa de Biologia Computacional i de Sistemes del MSKCC. "Vam haver d'inventar una sèrie de mètodes nous per respondre a preguntes que no s’acostumen a plantejar sobre plasticitat, comunicació cèl·lula a cèl·lula i progressió tumoral".
Per exemple, l'equip va inventar un nou mètode per mesurar la plasticitat d'una cèl·lula. També van descobrir que l'augment de la plasticitat conduïa a l'activació de gens relacionats amb la comunicació cèl·lula a cèl·lula: com els que codifiquen lligands i receptors.
"Bàsicament, les cèl·lules amb major plasticitat en resposta a l'oncogen KRAS i a un dany tissular expressen gens que els permeten enviar i rebre senyals específics del seu entorn i comunicar-se amb altres cèl·lules", explica la Dra. Pe'er. "Això dona a la cèl·lula la capacitat de respondre a senyals que una cèl·lula normal no podria. També tenen una major capacitat per comunicar-se amb les cèl·lules immunològiques i, com a resultat, el sistema immunitari que envolta aquestes cèl·lules comença a canviar".
A més, els investigadors van poder determinar que unes poques subpoblacions de cèl·lules, algunes d'elles força rares, es transformen en importants nuclis de comunicació, impulsant un bucle de retroalimentació que condueix al desenvolupament i la progressió del càncer de pàncrees.

L'estudi representa la culminació d'una línia de recerca iniciada per la Dra. Alonso-Curbelo, qui te l’objectiu de detallar el mecanisme pel qual la inflamació afavoreix la iniciació del càncer. "Aquest treball va ser possible gràcies a una sinergia entre ciència experimental i ciència computacional", afirma la Dra. Alonso-Curbelo.
L'equip va validar les prediccions computacionals amb diferents tècniques experimentals innovadores. "Per exemple, tècniques d'imatges ens van mostrar que les poblacions de cèl·lules que, segons els mètodes computacionals, parlaven entre si estaven molt més a prop unes de les altres al teixit", explica Burdziak.
Mitjançant experiments funcionals addicionals, l'equip va poder demostrar que aquestes converses impulsen el desenvolupament del càncer.
"Vam desenvolupar nous models genètics per bloquejar específicament la senyalització cèl·lula a cèl·lula associada a la plasticitat neoplàsica", afirma la Dra. Alonso-Curbelo, cap del laboratori d'Inflamació, Plasticitat Tissular i Càncer de l'IRB Barcelona.
"Aquestes anàlisis van demostrar que les xarxes de comunicació expansives que s'estableixen en les fases inicials del càncer de pàncrees són funcionalment rellevants i dirigeixen la tumorigènesi pancreàtica en ratolins".
Una possible via terapèutica
En conjunt, la investigació ofereix una nova visió, en alta resolució, de com les cèl·lules portadores d'una còpia mutada del gen KRAS adquireixen plasticitat i impulsen la progressió del càncer quan són sotmeses a inflamació.
"Això proporciona un nou full de ruta que pot ajudar a desenvolupar estratègies per detectar o, fins i tot, prevenir tumors pancreàtics abans que arribin a fases avançades", afirma el Dr. Lowe. "Entendre com les xarxes de comunicació entre cèl·lules impulsen l'inici del càncer de pàncrees és prometedor per al desenvolupament de teràpies que bloquegin o retardin la progressió primerenca del càncer, i fins i tot potencialment la malaltia més avançada".
“Desvetllar les característiques moleculars que defineixen les cèl·lules amb més plasticitat i capacitat per transformar-se en resposta a mutacions genètiques o senyals de l'entorn és un pas fonamental per entendre i interceptar els orígens del càncer”, conclou la Dra. Alonso-Curbelo.
Aquest treball ha estat finançat amb ajuts del “Alan and Sandra Gerry Metastasi and Tumor Ecosystems Center” del MSKCC, l'NCI (P30 CA008748, F31CA24690, U54 CA209975), la beca Postdoctoral Junior Leader de la Fundació “la Caixa” (LCF/BQ/ /11760006), la fundació FERO (II Ajuda FERO-ASEICA), el Ministerio de Ciencia e Innovación de España (PID2021-128102OA-I00), la Fundació Dieter Morszeck, Fraser Memorial Trust, McGill MI4 Platform, Howard Hughes Medical National Institutes of Health (R25 CA233208), la fundació Geoffrey Beene, i ajudes del National Institute of Child Health and Human Development (HD084071) i el Starr Cancer Consortium.
Article relacionat:
Epigenetic plasticity cooperates with cell-cell interactions to direct pancreatic tumorigenesis
Cassandra Burdziak†, Direna Alonso-Curbelo†, Thomas Walle, José Reyes, Francisco M. Barriga, Doron Haviv, Yubin Xie, Zhen Zhao, Chujun Julia Zhao, Hsuan-An Chen, Ojasvi Chaudhary, Ignas Masilionis, Zi-Ning Choo, Vianne Gao, Wei Luan, Alexandra Wuest, Yu-Jui Ho, Yuhong Wei, Daniela F. Quail, Richard Koche, Linas Mazutis, Ronan Chaligné, Tal Nawy, Scott W. Lowe*, Dana Pe’er*
†Equal contribution
Science (2022) DOI: 10.1126/science.add5327
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).