Images
- Investigadores del IRB Barcelona publican unas reglas para el diseño de nuevas moléculas con potencial farmacológico para tratar un amplio abanico de enfermedades, entre ellas, el cáncer de próstata.
- Estas moléculas, de naturaleza peptídica y que contienen únicamente aminoácidos naturales, son fáciles de generar, tienen elevada biocompatibilidad y cuentan con características farmacocinéticas favorables.
- El estudio se ha publicado en la revista Nature Communications.
Dentro de las células, las proteínas interactúan constantemente unas con otras para llevar a cabo diferentes funciones. Para hacer frente a algunas patologías en las que dichas funciones se encuentran alteradas, bloquear la unión entre dos o más proteínas es una posible aproximación terapéutica.
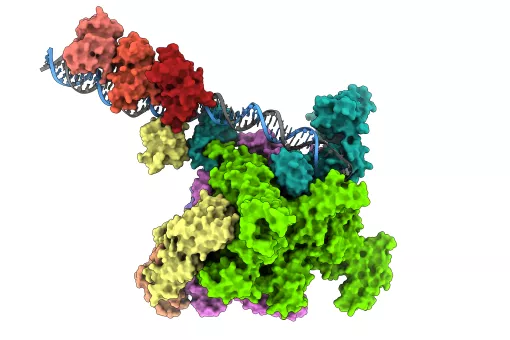
Científicos del IRB Barcelona liderados por el investigador ICREA Dr. Xavier Salvatella han publicado en la revista Nature Communications unas directrices para diseñar moléculas sintéticas que bloquean la interacción entre dos proteínas. En concreto, los investigadores se han centrado en las interacciones que se caracterizan por la unión de una hélice alfa de una de las proteínas sobre la superficie de otra proteína. Este es un modo de interacción muy común y prevalente en funciones celulares con interés terapéutico relacionadas con enfermedades como el cáncer de próstata.
Las pautas que se establecen en este trabajo permiten generar moléculas de manera relativamente sencilla que bloquean la unión de (potencialmente) cualquier interacción entre una proteína globular y una hélice alfa, ofreciendo una elevada versatilidad. Estas moléculas sintéticas presentan, además, una elevada estabilidad, son solubles en agua y pueden alcanzar el interior de la célula. Estas características las convierten en buenas candidatas a fármacos.
“Nuestro trabajo propone una manera sencilla de bloquear interacciones entre proteínas globulares mediadas por hélices alfa y puede beneficiar tanto a la ingeniería de proteínas como al desarrollo de nuevos fármacos”, explica el Dr. Salvatella, jefe del Laboratorio de Biofísica Molecular del IRB Barcelona. “Es una aproximación que parte de la investigación de las interacciones naturales entre ciertas proteínas, que hemos llevado a cabo en nuestro laboratorio, y que propone utilizar este conocimiento para lograr objetivos terapéuticos mediante el diseño de pequeñas moléculas con secuencias artificiales”, añade.
Competencia por el sitio de unión
Cuando dos proteínas se “reconocen” en la célula e interaccionan es porque alguna región en la superficie de ambas “encaja” y así pueden unirse. Las moléculas a las que hace referencia este trabajo, al igual que muchos fármacos de uso común, mimetizan dicha región de la superficie de una de las proteínas participantes en la interacción, de forma que “compiten” por unirse a la superficie de la otra proteína, también llamada “proteína diana”. Así, si la molécula competidora se encuentra en una concentración mayor, o bien tiene más afinidad por la proteína diana, ocupará todos los puntos de unión y bloqueará cualquier posible interacción con la proteína original a la que el fármaco mimetiza. Sin embargo, mimetizar la superficie de unión entre dos proteínas grandes es complicado debido a su tamaño y estructura.
“Lo que proponemos en este trabajo es la creación/generación de moléculas con forma de hélice alfa que ofrecen una superficie configurable para encajar con la proteína diana y detallamos cómo hacer que esa hélice se mantenga con una estructura estable en el contexto celular”, explica el Dr. Albert Escobedo, actualmente investigador postdoctoral en el Centro de Regulación Genómica (CRG), quien ha liderado el trabajo junto al Dr. Salvatella en el IRB Barcelona.
Caracterizar las interacciones y buscar una estructura estable
El esfuerzo de los investigadores se ha centrado en detallar las características que deben cumplir esas moléculas sintéticas para tener una estructura estable y poder ejercer su función de inhibir la interacción entre dos proteínas.
En el estudio describen cómo varias repeticiones de pares del aminoácido glutamina, junto a otro aminoácido hidrofóbico con una periodicidad determinada, confieren estabilidad a la hélice. A diferencia de otras estrategias con finalidades similares, el uso exclusivo de aminoácidos naturales y la ausencia de modificaciones químicas para estabilizar la hélice puede repercutir positivamente en la biocompatibilidad y seguridad de los fármacos diseñados con las nuevas pautas descubiertas.
Los investigadores ya habían observado en 2019, en otro estudio publicado en Nature Communications que, para una proteína determinada, el número de glutaminas presente en la estructura condiciona la estabilidad de su estructura en forma de hélice. En este trabajo han comprobado que esto mismo ocurre también en otras proteínas, explican el por qué y aplican el conocimiento adquirido para aumentar la versatilidad de las moléculas diseñadas. Además, muestran cómo los cambios en el numero de glutaminas en diferentes proteínas pueden provocar distintas enfermedades.
El trabajo se ha llevado a cabo en colaboración con el laboratorio del Dr. Modesto Orozco en el IRB Barcelona y científicos del Instituto de Química Avanzada de Catalunya (IQAC-CSIC), el Max Planck Institute for Biology, la Universidad de Barcelona (UB), la Universidad de Copenhague, el Instituto de Parasitología y Biomedicina López Neyra del CSIC, y el CIC bioGUNE.
El estudio ha contado con el apoyo de la Asociación Española Contra el Cáncer, el Consejo Europeo de Investigación (ERC), el Ministerio de Ciencia e Innovación (MICINN), la Agencia Catalana de Gestión de Ayudas Universitarias y de Investigación (AGAUR), la fundación Novo Nordisk y el Instituto Nacional de Bioinformática.
Artículo relacionado:
A glutamine-based single α-helix scaffold to target globular proteins
Albert Escobedo, Jonathan Piccirillo, Juan Aranda, Tammo Diercks, Borja Mateos, Carla Garcia-Cabau, Macarena Sánchez-Navarro, Busra Topal, Mateusz Biesaga, Lasse Staby, Birthe B. Kragelund, Jesús García, Oscar Millet, Modesto Orozco, Murray Coles, Ramon Crehuet & Xavier Salvatella
Nature Communications (2022) DOI: 10.1038/s41467-022-34793-6
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).