Images
- Investigadors de l'IRB Barcelona publiquen unes regles per al disseny de noves molècules amb potencial farmacològic per tractar un ampli ventall de malalties, entre elles, el càncer de pròstata.
- Aquestes molècules, de naturalesa peptídica i que contenen únicament aminoàcids naturals, són fàcils de generar, tenen una biocompatibilitat elevada i compten amb característiques farmacocinètiques favorables.
- L'estudi s'ha publicat a la revista Nature Communications.
Dins de les cèl·lules, les proteïnes interactuen constantment les unes amb les altres per dur a terme diferents funcions. Per fer front a algunes patologies en les quals aquestes funcions es troben alterades, bloquejar la unió entre dues o més proteïnes és una possible aproximació terapèutica.
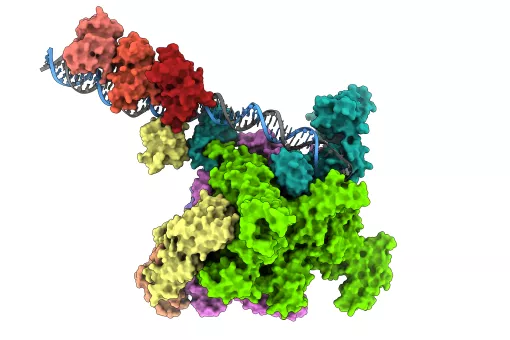
Científics de l'IRB Barcelona liderats per l'investigador ICREA Dr. Xavier Salvatella han publicat a la revista Nature Communications unes directrius per dissenyar molècules sintètiques que bloquegen la interacció entre dues proteïnes. En concret, els investigadors s'han centrat en les interaccions que es caracteritzen per unir una hèlix alfa d'una de les proteïnes sobre la superfície de l'altra proteïna. Aquest és un mode d'interacció molt comú i prevalent en funcions cel·lulars amb interès terapèutic relacionades amb malalties com el càncer de pròstata.
Les pautes que s'estableixen en aquest treball permeten generar molècules de manera relativament senzilla que bloquegen la unió de (potencialment) qualsevol interacció entre una proteïna globular i una hèlix alfa, oferint una versatilitat elevada. Aquestes molècules sintètiques presenten, a més, una estabilitat elevada, són solubles en aigua i poden arribar a l'interior de la cèl·lula. Aquestes característiques les converteixen en bones candidates a fàrmacs.
“El nostre treball proposa una manera senzilla de bloquejar interaccions entre proteïnes globulars intervingudes per hèlixs alfa i pot beneficiar tant l'enginyeria de proteïnes com el desenvolupament de nous fàrmacs”, explica el Dr. Salvatella, cap del Laboratori de Biofísica Molecular de l'IRB Barcelona. “És una aproximació que parteix de la investigació de les interaccions naturals entre certes proteïnes, que hem dut a terme al nostre laboratori, i que proposa l’aplicació d’aquest coneixement per assolir objectius terapèutics mitjançant el disseny de petites molècules amb seqüències artificials”, afegeix.
Competència pel lloc d'unió
Quan dues proteïnes es “reconeixen” a la cèl·lula i interaccionen és perquè alguna regió a la superfície d'ambdues “encaixa” i així es poden unir. Les molècules a les quals es fa referència aquest treball, igual que molts fàrmacs d'ús comú, mimetitzen aquesta regió de la superfície d'una de les proteïnes participants a la interacció, de manera que “competeixen” per unir-se a la superfície de l'altra proteïna , també anomenada “proteïna diana”. Així, si la molècula competidora es troba en una concentració més gran o bé té més afinitat per la proteïna diana ocuparà tots els punts d'unió i bloquejarà qualsevol possible interacció amb la proteïna original a la qual el fàrmac mimetitza. No obstant això, mimetitzar la superfície d'unió entre dues proteïnes grans és complicat per la seva mida i estructura.
“El que proposem en aquest treball és la creació de molècules amb forma d'hèlix alfa que ofereixen una superfície configurable per encaixar amb la proteïna diana, i detallem com fer que aquesta hèlix es mantingui amb una estructura estable en el context cel·lular”, explica el Dr. Albert Escobedo, actualment investigador postdoctoral al Centre de Regulació Genòmica (CRG), que ha liderat el treball juntament amb el Dr. Salvatella a l'IRB Barcelona.
Caracteritzar les interaccions i buscar una estructura estable
L'esforç dels investigadors s'ha centrat en detallar les característiques que han de complir aquestes molècules sintètiques per tenir una estructura estable i poder exercir la funció d'inhibir la interacció entre dues proteïnes. A l'estudi descriuen com diverses repeticions de parells de l'aminoàcid glutamina juntament amb un altre aminoàcid hidrofòbic amb una periodicitat determinada confereixen estabilitat a l'hèlix.
A diferència d'altres estratègies amb finalitats similars, l'ús exclusiu d'aminoàcids naturals i l'absència de modificacions químiques per estabilitzar l'hèlix pot repercutir positivament en la biocompatibilitat i la seguretat dels fàrmacs dissenyats amb les noves pautes descobertes.
Els investigadors ja havien observat el 2019, en un altre estudi publicat a Nature Communications que, per a una proteïna determinada, el nombre de glutamines present a l'estructura condiciona l'estabilitat de la seva estructura en forma d'hèlix. En aquest treball han comprovat que això mateix passa també en altres proteïnes, expliquen el perquè i usen el coneixement adquirit per augmentar la versatilitat de les molècules dissenyades. A més, proposen com canvis en el nombre de glutamines a diferents proteïnes poden provocar diferents malalties.
El treball s'ha realitzat en col·laboració amb el laboratori que lidera el Dr. Modesto Orozco a l’IRB Barcelona i investigadors de l'Institut de Química Avançada de Catalunya (IQAC-CSIC), el Max Planck Institute for Biology, la Universitat de Barcelona (UB), la Universitat de Copenhaguen, l'Institut de Parasitologia i Biomedicina López Neyra del CSIC i el CIC bioGUNE.
L'estudi ha comptat amb el suport de l'Asociación Española Contra el Cáncer, el Consell Europeu de Recerca (ERC), el Ministeri espanyol de Ciència i Innovació (MICINN), l'Agència Catalana de Gestió d'Ajuts Universitaris i de Recerca (AGAUR), la Fundació Novo Nordisk i l'Institut Nacional de Bioinformàtica.
Article relacionat:
A glutamine-based single α-helix scaffold to target globular proteins
Albert Escobedo, Jonathan Piccirillo, Juan Aranda, Tammo Diercks, Borja Mateos, Carla Garcia-Cabau, Macarena Sánchez-Navarro, Busra Topal, Mateusz Biesaga, Lasse Staby, Birthe B. Kragelund, Jesús García, Oscar Millet, Modesto Orozco, Murray Coles, Ramon Crehuet & Xavier Salvatella
Nature Communications (2022) DOI: 10.1038/s41467-022-34793-6
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).