Images
p38α es una proteína implicada en enfermedades inflamatorias crónicas y cáncer, entre otras condiciones patológicas.
Publicado en la revista eLife, el estudio proporciona una comprensión más profunda de la estructura de la proteína, abriendo así el camino para el desarrollo de inhibidores más eficaces.
Este trabajo es el resultado de la combinación de datos biológicos fundamentales mediante técnicas computacionales.
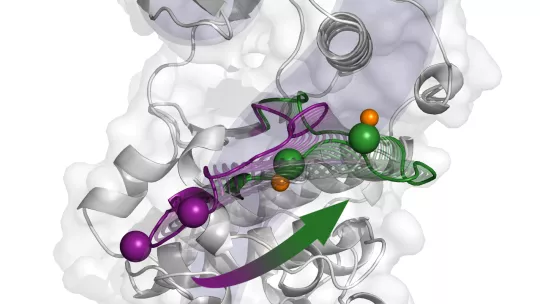
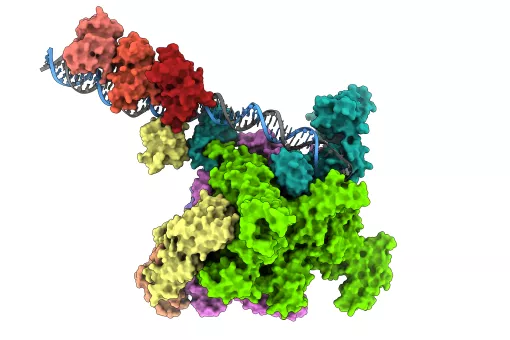
La proteína p38α es un miembro de una familia de moléculas que transmiten señales desde el exterior a toda la célula, permitiendo así una respuesta celular apropiada, como la proliferación, diferenciación, senescencia o muerte. A su vez, la participación de p38α en condiciones patológicas, como las enfermedades inflamatorias crónicas y el cáncer, la convierten en un prometedor objetivo farmacológico. En este sentido, una imagen completa del mecanismo de activación de la proteína es esencial para diseñar inhibidores específicos que no afecten a otros procesos.
La revista eLife ha publicado un estudio sobre p38α realizado por Antonija Kuzmanic, una investigadora del programa Marie Curie COFUND de la UE, que lleva a cabo una formación postdoctoral simultáneamente en dos laboratorios del IRB Barcelona: el Laboratorio de Modelización Molecular y Bioinformática y el Laboratorio de Señalización y Ciclo Celular. La colaboración entre el laboratorio liderado por Modesto Orozco y el que lidera Angel R. Nebreda, experto de renombre mundial en p38α, ha proporcionado una imagen integradora del mecanismo de activación de p38α y nuevos conocimientos sobre los efectos moleculares de varias moléculas que regulan la actividad enzimática de la proteína.
Usando técnicas computacionales, los investigadores han descifrado los elementos clave del mecanismo molecular complejo que subyace a la actividad de p38α. Este estudio describe el mecanismo de activación de la proteína en un detalle sin precedentes y concilia los resultados aparentemente contradictorios de estudios estructurales previos. "Teniendo en cuenta la importancia de la proteína p38α para los procesos patológicos, esperamos que el conocimiento obtenido en este estudio ayude a dirigir la proteína con más especificidad", destaca Antonija Kuzmanic, autora principal del estudio.
Identificando nuevos inhibidores
p38α ha sido diana de enfermedades inflamatorias y algunos tipos de cáncer. Sin embargo, ningún fármaco ha llegado aún al mercado. "Nuestro estudio revela nuevas conformaciones de la proteína, que podrían ser utilizadas como punto de partida en los estudios de cribado virtual, con el objetivo de descubrir nuevos inhibidores", explica Kuzmanic. Y añade: "También hemos podido resaltar importantes interacciones electrostáticas, lo que nos permite explorar rutas alternativas de activación con mayor especificidad".
Un enfoque de biología computacional
"Usamos únicamente técnicas computacionales. Principalmente, hemos empleado numerosas simulaciones de dinámica molecular combinadas con una técnica de muestreo avanzada llamada ‘metadinámica’", explica Kuzmanic. Esta combinación da a los investigadores una ventaja sobre las simulaciones estándar de dinámica molecular, ya que les permite observar grandes cambios conformacionales en una cantidad razonable de tiempo computacional. Además, "somos capaces de añadir significación estadística a las conformaciones que observamos en nuestras simulaciones".
Este estudio ha recibido el apoyo de Seventh Framework Programme, Engineering and Physical Sciences Research Council, European Research Council, Horizon 2020, y el Ministerio de Economía, Industria y Competitividad (MINECO).
Artículo de referencia:
Antonija Kuzmanic, Ludovico Sutto, Giorgio Saladino, Angel R. Nebreda, Francesco L. Gervasio and Modesto Orozco.
Changes in the free-energy landscape of p38α MAP kinase through its canonical activation and binding events as studied by enhanced molecular dynamics simulations
eLife (2017) DOI: 10.7554/eLife.22175
Sobre el IRB Barcelona
Creado en 2005 por la Generalitat de Catalunya y la Universidad de Barcelona, el IRB Barcelona es Centro de Excelencia Severo Ochoa desde 2011. Su objetivo es hacer investigación de excelencia en biomedicina y mejorar la calidad de vida de las personas y, al mismo tiempo, cuidar la formación de talento, la transferencia tecnológica y la comunicación social de la ciencia. Los 24 laboratorios y siete plataformas tecnológicas trabajan para responder a preguntas básicas en biología y orientadas a enfermedades como el cáncer, la metástasis, el Alzheimer, la diabetes y enfermedades raras. Es un centro internacional que acoge más de 400 trabajadores de 36 nacionalidades. Está ubicado en el Parque Científico de Barcelona. El IRB Barcelona forma parte del Barcelona Institute of Science and Technology (BIST) y la red de Centros de Investigación de Catalunya (CERCA).
IRB Barcelona
El Instituto de Investigación Biomédica (IRB Barcelona) trabaja para conseguir una vida libre de enfermedades. Desarrolla una investigación multidisciplinar de excelencia para curar el cáncer y otras enfermedades vinculadas al envejecimiento. Establece colaboraciones con la industria farmacéutica y los principales hospitales para hacer llegar los resultados de la investigación a la sociedad, a través de la transferencia de tecnología, y realiza diferentes iniciativas de divulgación científica para mantener un diálogo abierto con la ciudadanía. El IRB Barcelona es un centro internacional que acoge alrededor de 400 científicos de más de 30 nacionalidades. Reconocido como Centro de Excelencia Severo Ochoa desde 2011, es un centro CERCA y miembro del Barcelona Institute of Science and Technology (BIST).