Images
L'anticòs mAb806 és utilitzat en el tractament de glioblastoma, encara que fins ara es desconeixia el seu mecanisme d'acció.
L'estudi, publicat a la revista PNAS, posa les bases per estendre el tractament amb mAb806 a més tipus de tumors i realitzar teràpies més específiques.
El glioblastoma és un tipus de tumor cerebral incurable, que s'associa freqüentment a mutacions en el receptor del factor de creixement epidèrmic (EGFR, per les sigles en anglès). La principal mutació d'EGFR trobada en aquest tumor, coneguda com a EGFRvIII, és tractada amb l'anticòs mAb806, un fàrmac desenvolupat pel Ludwig Institute for Cancer Research (EUA) fa gairebé 20 anys, però del que es desconeixia el seu mecanisme d'acció. Ara, científics de l'Institut de Recerca Biomèdica (IRB Barcelona), en col·laboració amb les Universitats d'Estocolm (Suècia) i de Califòrnia (EUA), han aconseguit comprendre com aquest anticòs actua sobre el receptor EGFR mutat, estenent així el tractament a virtualment totes les mutacions de glioblastoma.
L'estudi, publicat a la revista PNAS, obre noves vies pel tractament del càncer. D'una banda, els resultats obtinguts indiquen que mAb806 podria utilitzar-se en multitud de tumors en els quals EGFR es troba mutat i no només en una mutació concreta com es pensava fins ara.
D'altra banda, aquest equip d'investigadors ha demostrat que, encara que EGFR no estigui mutat, aquest pot ser tractat per fer-ho susceptible al tractament amb mAb806. "Aquesta troballa posa les bases racionals per a realitzar teràpies combinades anti-EGFR amb anticossos i inhibidors de quinasa, en lloc de provar-los" a cegues "com s'ha fet fins ara" comenta Modesto Orozco, cap del laboratori de Modelització Molecular i Bioinformàtica de l'IRB Barcelona i catedràtic de la Facultat de Química de la Universitat de Barcelona.
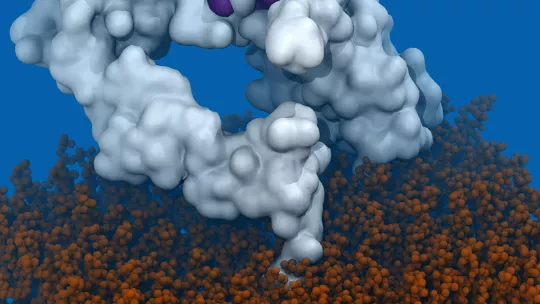
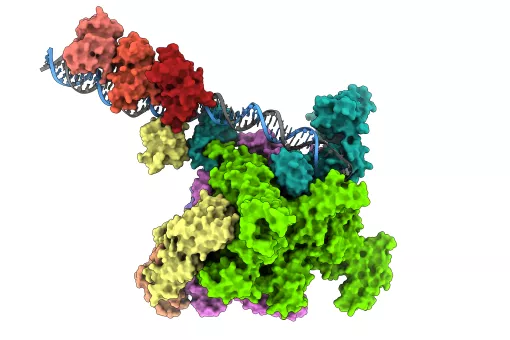
S'han descrit més de 100 mutacions diferents en EGFR que donen lloc a glioblastoma. Mitjançant simulació computacional, la primera autora d'aquest article i investigadora a la Universitat d'Estocolm (Suècia), Laura Orellana, que va començar aquest projecte durant els seus estudis de doctorat a l'IRB Barcelona, va descobrir que les mutacions estudiades induïen un canvi similar en la forma d'aquest receptor. "Sorprenentment, aquest canvi en EGFR encaixa perfectament amb la forma que reconeix l'anticòs mAb806, però que abans no havia estat vista experimentalment" comenta Orellana.
En estudis anteriors s'havia descrit que l'anticòs mAb806 reconeix una regió d'EGFR normalment oculta. En els tumors portadors d'EGFRvIII, la meitat d'aquest receptor havia estat eliminada, de manera que aquesta regió resultava accessible i per tant es podia utilitzar aquest anticòs per al seu tractament. Ara s'ha comprovat que diferents mutacions en EGFR duen a terme un canvi en la seva forma que també permet que aquesta regió sigui detectable per mAb806.
Aquests canvis en la forma d'EGFR afecten la seva activació. Analitzant simulacions computacionals d'EGFR, Orellana va descobrir que mentre a EGFRvIII una part del receptor és "eliminada", en altres mutants aquesta mateixa part és "desplaçada", amb el mateix objectiu d'activar el receptor.
"Aquesta sorprenent troballa proporciona una base racional per entendre per què diferents mutacions de glioblastoma presenten una resposta similar als fàrmacs" indica Orellana, "mutacions aparentment diferents són en realitat equivalents i causen el mateix efecte sobre el receptor duent a l'aparició de tumors".
Aquesta hipòtesi computacional va ser confirmada mitjançant models cel·lulars i animals en col·laboració amb el Ludwig Institute i la Universitat de Califòrnia a San Diego (UCSD), que van demostrar el seu potencial terapèutic.
"Atès que hi ha nombrosos assajos clínics en marxa amb mAb806 a escala mundial, la translació d'aquests resultats a la clínica serà molt més ràpida del que és habitual, i es preveu que sigui aplicable a molts tipus de tumors portadors de mutacions similars, com els de còlon, mama o pell "comenta Orozco.
L'estudi és una col·laboració entre l'IRB Barcelona, el Royal Institute of Technology (KTH) d'Estocolm, la Universitat d'Estocolm, el Ludwig Institute for Cancer Research, la Universitat de Califòrnia San Diego, el Barcelona Supercomputing Center, la Universitat de Lisboa i al Centre de Biochimie Structurale (CNRS).
L'estudi ha comptat amb el finançament del Ministeri de Ciència, Innovació i Universitats, ICREA, la Generalitat de Catalunya, el Consell Europeu de Recerca (ERC per les seves sigles en anglès), Vetenskapsrådet and Swedish e-Science Research Center (E.L.).
Article de referencia
Laura Orellana, Amy H. Thorne, Rafael Lema, Johan Gustavsson, Alison D. Parisian, Adam Hospital, Tiago N. Codeiro, Pau Bernadó, Andrew M. Scott, Isabelle Brun-Heath, Erik Lindahl, Webster K. Cavenee, Frank Funari and Modesto Orozco.
PNAS (2019) doi: 10.1073/pnas.1821442116.
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).