El Repte Metàstasi és una crida de l’IRB Barcelona a tota la societat per combatre la metàstasi. Volem involucrar ciutadans, institucions i empreses per recaptar 5 milions d’euros que ens permetran accelerar la recerca, captant nou talent, adquirint tecnologia capdavantera i habilitant nous espais de laboratori.
La metàstasi és l’expansió del càncer a diferents òrgans del cos. Malgrat els avenços en recerca oncològica dels darrers anys, la metàstasi continua essent responsable del 90% de les morts per càncer. Coneixem bé els tumors i sabem com tractar-los, però encara ens queda molt de camí per diagnosticar, prevenir i curar la metàstasi.
Descobreix en el següent vídeo els avanços que hem realitzat en recerca de metàstasi
Què és la metàstasi
1. Què és la metàstasi?
El càncer és una malaltia causada per errors denominats “mutacions” en el material genètic (és a dir, a l’ADN) de les nostres cèl·lules. Si el cos no és capaç de corregir aquestes mutacions, s’acumulen fent que les cèl·lules es multipliquin de manera descontrolada i donin lloc a tumors.
La metàstasi és l’extensió del càncer des del tumor primari (tumor original) a altres òrgans vitals com el cervell, el pulmó o el fetge, a través dels vasos sanguinis o limfàtics. Els tumors primaris rarament són letals. En canvi, la metàstasi és difícil de controlar.
La paraula “metàstasi” s’utilitza en el context dels tumors sòlids, és a dir, aquells que no s'originen en les cèl·lules de les sang. Aquests últims reben el nom de “tumors líquids”. Els més comuns són les leucèmies i els limfomes.
En les últimes dècades, la recerca centrada en l’estat inicial de la malaltia (tumor primari) ha permès millorar significativament la supervivència dels pacients. Actualment, gràcies als avenços a nivell de tècniques quirúrgiques, tractaments i protocols de detecció precoç, el 60% dels càncers es curen o es cronifiquen.
Malauradament, la metàstasi no es comporta com els tumors primaris, i això fa que les teràpies disponibles no funcionin per tractar la majoria dels pacients que la pateixen. Per això, és urgent idear noves estratègies per a la prevenció, diagnòstic i tractament de la metàstasi.
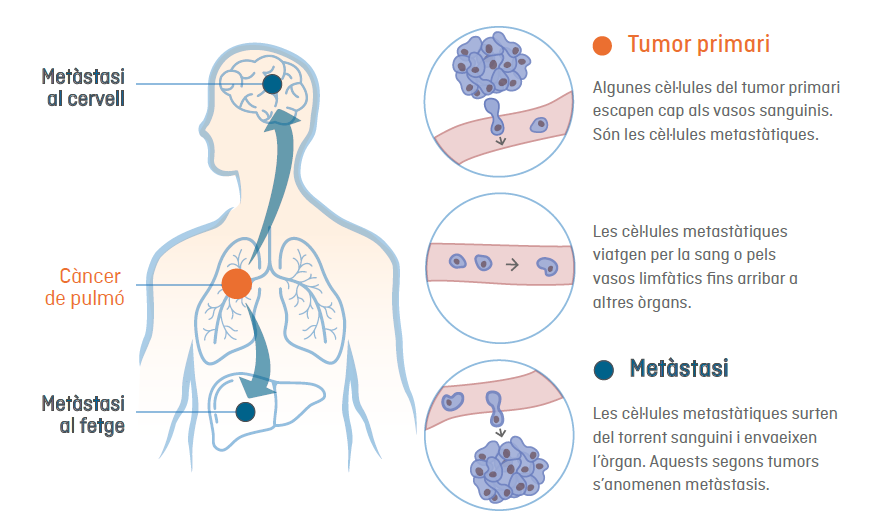
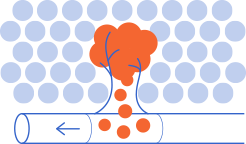
Com es mostra a la imatge superior, en les metàstasis, les cèl·lules canceroses es separen del tumor primari per formar nous tumors en altres parts del cos. Les cèl·lules tumorals poden viatjar a través dels vasos limfàtics o sanguinis propers al tumor primari, fins arribar a l'òrgan on fan metàstasi.
2. Com es desenvolupa la metàstasi?
La metàstasi s’origina a partir de cèl·lules canceroses que tenen la capacitat de marxar del tumor primari i arribar a un altre òrgan, on s’instal·len i donen lloc a un nou tumor (metàstasi).
Perquè això sigui possible, aquestes cèl·lules han de “viatjar” seguint quatre fases:
- Abandonar el tumor primari.
- Introduir-se en el torrent sanguini o limfàtic i sobreviure mentre circulen pel cos.
- Sortir de la circulació i colonitzar l'òrgan al qual arriben
- Adaptar-se a les noves condicions, que són molt diferents de les del seu òrgan d’origen. A vegades, les cèl·lules es mantenen en estat latent fins que les condicions són favorables pel seu creixement. Aquest viatge es coneix com a “cascada metastàtica”.
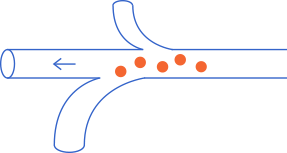
La majoria de cèl·lules que escapen del tumor no son capaces de sobreviure en el torrent sanguini i/o limfàtic. Només aquelles cèl·lules que adquireixen característiques avantatjoses per sobreviure fora del tumor són capaces de colonitzar altres òrgans. Algunes d’aquestes característiques són la baixa multiplicació (que produeix resistència a la quimioteràpia) i la capacitat de ser invisibles davant de les cèl·lules del sistema immunitari.
Des del punt de vista terapèutic, entendre com les cèl·lules canceroses adquireixen la capacitat de deixar el tumor primari i viatjar és important per prevenir les metàstasis en pacients diagnosticats amb tumors primaris,mentre que entendre les característiques adquirides per les cèl·lules que arriben a l’òrgan secundari amb èxit (colonització exitosa) pot conduir a teràpies efectives per als pacients que ja tenen metàstasi

3. Què és la recaiguda del càncer?
La recaiguda (també coneguda com a “recurrència” o “recidiva”) és la reaparició del càncer després que el tumor primari hagi estat eliminat mitjançant cirurgia o quimioteràpia i quan la malaltia ha estat indetectable durant un determinat període de temps. La recurrència pot ser local (quan el tumor torna a créixer en el lloc primari) o, més habitualment, en forma de metàstasi (el tumor creix en un òrgan distant). Un dels factors que explica la recurrència és el fet que les cèl·lules iniciadores de la metàstasi poden entrar en un estat de latència en el qual no es multipliquen. Això les fa resistents a la quimioteràpia, que ataca principalment les cèl·lules que proliferen.
Les cèl·lules metastàtiques entren en “hibernació” (o en estat latent) perquè les condicions físiques, metabòliques (disponibilitat de nutrients, oxigen, etc.) i immunitàries de l’òrgan col·lonitzat (òrgan hoste) en dificulten la multiplicació. Es mantenen en aquest estat fins que les condicions de l’ambient són favorables per generar un nou tumor.
En alguns casos, les cèl·lules tumorals envien senyals a les cèl·lules residents de l’òrgan hoste per generar condicions propícies, com la creació de nous vasos sanguinis a través dels quals els arribin nutrients i oxigen per créixer. Al mateix temps, les cèl·lules metastàtiques poden patir mutacions (canvis en el material genètic o ADN) que les concedeixen característiques beneficioses per sobreviure, com per exemple, esdevenir invisibles per al sistema immunitari i evitar així ser detectades i eliminades.
En la majoria dels casos, les cèl·lules metastàtiques poden mantenir-se latents durant mesos, anys o, fins i tot, dècades, abans de formar una metàstasi clínicament detectable. Alguns tumors primaris tenen més probabilitats de desenvolupar metàstasi que d’altres (columna “taxa de recaiguda metastàtica” de la següent taula), i el temps d’aparició d’aquestes metàstasis varia en funció de l’òrgan en el qual s’origina el tumor primari (columna “interval de latencia” de la següent taula):
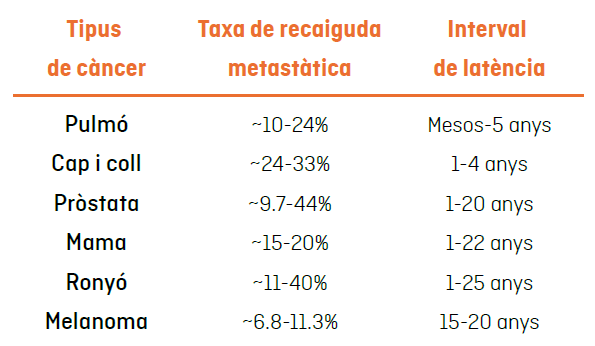
En la taula de dalt es mostra la taxa de recaiguda metastàtica i interval de latència en pacients amb diferents tipus de càncer. La taxa de recaiguda metastàtica fa referència al risc de tenir una recaiguda després d’eliminar el tumor primari i l’interval de latència fa referència al període de temps en el qual pot succeir la recaiguda. Taula adaptada de Kim Marquez-Palencia & Malladi, Front. Immunol. (2019).
4. En quins òrgans fan metàstasi els tumors primaris?
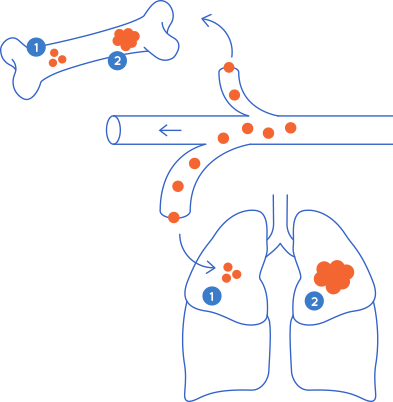
L’òrgan en el qual es desenvoluparà la metàstasi depèn de l'òrgan en què s’ha originat el càncer. És més probable que certs tipus de càncer es disseminin a òrgans concrets, fet que s’anomena “organotropisme metastàtic”. En alguns casos, els tumors primaris poden generar metàstasi en més d’un òrgan al mateix temps.
L’organotropisme metastàtic resulta de la capacitat de les cèl·lules canceroses per arribar a òrgans determinats a través de la circulació. Per exemple, el càncer de còlon acostuma a fer metàstasi al fetge perquè el circuit que segueix la sang que drena els intestins flueix cap al fetge a través la vena porta hepàtica2. Un cop s’ha generat la metàstasi al fetge, es pot generar una metàstasi secundària als pulmons, fet conegut com a “metàstasi seqüencial”.
Les cèl·lules d’un mateix tipus de càncer poden tenir diferents trajectes (o “tropismes”) en funció de les seves propietats. Un exemple són els diferents subtipus de càncer de mama: els tumors positius per als receptors d’estrogen (ER+) són més propensos a fer metàstasi als ossos, mentre que els tumors ER- tendeixen a anar a òrgans com els pulmons, el fetge o el cervell.
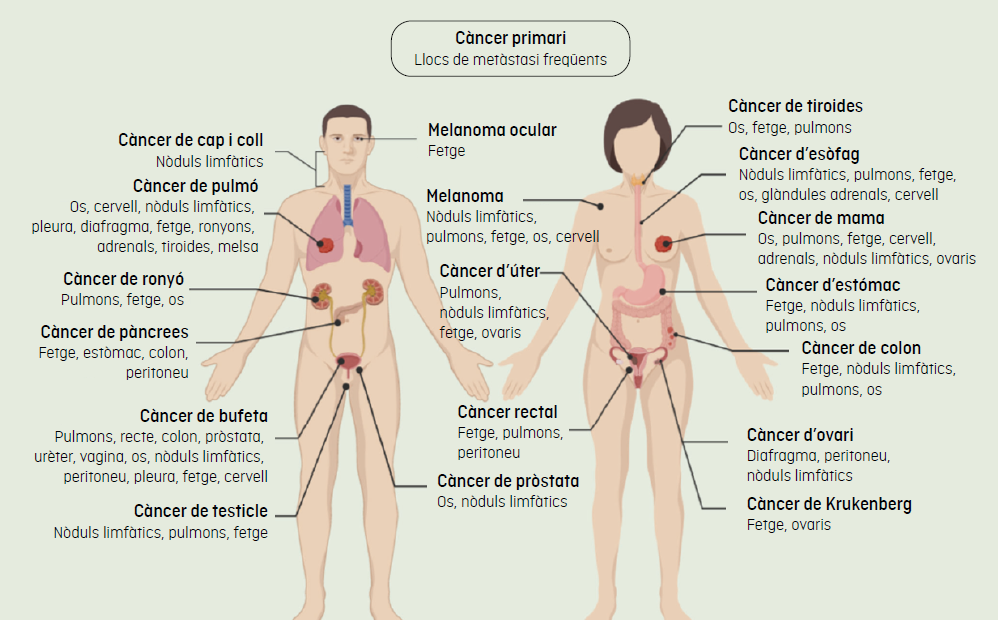
A la imatge de dalt s'observen els trajectes habituals de la metàstasi. Les observacions clíniques suggereixen que la majoria dels càncers fan metàstasi a òrgans específics, un procés conegut com a "organotropisme metastàtic". Adaptació de Fares J. et al, Nature, 2020.
5. Com es detecta la metàstasi?
En les primeres fases de la metàstasi, el nombre de cèl·lules que aconsegueixen sobreviure és molt baix. En la majoria de casos, es tracta de cèl·lules aïllades o que es troben en petits grups (“micrometàstasis”), fet que en dificulta molt la detecció pels mètodes de diagnòstic d’imatge convencionals, com la tomografia per emissió de positrons (PET) o la ressonància magnètica (RMN).
Els mètodes de detecció precoç de la metàstasi tenen com a objectiu trobar les cèl·lules tumorals abans que arribin a l’òrgan on faran metàstasi. Una pràctica molt estesa és l'anàlisi exhaustiva del gangli limfàtic més proper al tumor primari, anomenat “gangli sentinella”, al qual és probable que el càncer es dissemini en primer lloc. En el cas de presentar cèl·lules tumorals, aquest gangli es sol extirpar per actuar com a “tallafocs”.
Altres mètodes tenen com a objectiu detectar el rastre de cèl·lules tumorals en circulació mitjançant mostres (biòpsies) de la sang. Es poden fer mitjançant la detecció de senyals (“biomarcadors”) específics en la superficie de les cèl·lules tumorals que les diferenciïn de la resta de cèl·lules de la sang o per mitjà de la detecció de material genètic (ADN) o vesícules (“exosomes”) circulants procedents de cèl·lules tumorals.
En tots tres casos, el baix número de cèl·lules presents en els primers estadis de la metàstasi segueix sent el principal obstacle per al diagnòstic fiable de la malaltia. Per aquest motiu, en el darrers anys s’estan fent grans esforços per descriure com són les cèl·lules originàries de la metàstasi i per millorar la sensibilitat dels mètodes de diagnòstic.
6. Per què és tan difícil de tractar la metàstasi?
La majoria dels medicaments oncològics no són efectius en el tractament de la metàstasi, sovint degut a que les cèl·lules metastàtiques adquireixen mecanismes de resistència a la teràpia. La immunoteràpia (teràpia que millora les cèl·lules del sistema immunitari del pacient) està emergint com una estratègia revolucionària per a la remissió o cronificació d’alguns tipus de càncer avançat però, malauradament, encara no existeixen opcions efectives per a la majoria de càncers metàstàtics.
Sovint, el propòsit dels tractaments de les metàstasis es detenir-ne el creixement per tal d’evitar l’avenç de la malaltia i aconseguir cronificar-la. Si el càncer metastàtic respon bé al tractament, algunes persones poden arribar a viure anys després del diagnòstic inicial de la metàstasi.
Els factors que contribueixen a que les metàstasis siguin difícils d’eliminar són els següents:
- En molts casos, les metàstasis es desenvolupen en òrgans vitals, com els pulmons o el cervell, fet que fa que generalment no siguin operables, ja que afectarien el funcionament de l’òrgan afectat i posarien en risc la vida del pacient.
- Les cèl·lules metastàtiques tenen característiques diferents a les cèl·lules del tumor primari, el qual, en certs casos, les confereix resistència als tractaments als quals les cèl·lules del tumor primari eren sensibles1. Aquestes característiques, que solen ser avantatjoses per a la supervivència de les cèl·lules metastàtiques, s’adquireixen a partir de mutacions que s’acumulen en l’ADN.
- Les micrometàstasis estan formades per una o vàries cèl·lules que, en molt casos, es troben “adormides” (latents) fins tenir condicions favorables per multiplicarse. Cèl·lules individuals o grups petits de cèl·lules que són difícils de detectar per les tècniques de diagnòstic d’imatge convencionals (tomografia per emissió de positrons (PET), la ressonància magnètica (RMN), etc.) la qual cosa les fa difícils de detectar.
Un dels reptes actuals de la recerca biomèdica és desenvolupar mètodes per a la detecció de les micrometàstasis, així com entendre millor les febleses de les cèl·lules metastàtiques per poder dissenyar estratègies terapèutiques que permetin la seva eliminació.
7. Què fem a l’IRB Barcelona per vèncer la metàstasi?
La metàstasi no es comporta com els tumors primaris ni respon als mateixos tractaments, la qual cosa la converteix en una malaltia extremadament complexa. A l’IRB Barcelona concentrem la nostra experiència multidisciplinària en l’estudi de la metàstasi per entendre com es desenvolupa i poder aturar-la.
El nostre objectiu és contribuir a donar resposta a tres preguntes fonamentals:
- Com podem predir el risc de recaiguda del càncer?
- Com es pot prevenir la metàstasi?
- Com es pot tractar la metàstasi?
A l'IRB Barcelona disposem de 30 grups de recerca diferents en els quals s'agrupen més de 450 científics especialistes en diferents disciplines. Cadascun dels 30 laboratoris compta amb un equip multdisciplinar on biòlegs, químics, informàtics o metges treballen plegats en una mateixa línia d'investigació i amb la tecnologia més avançada en microscòpia, seqüenciació del genoma, bioinformàtica o síntesi de compostos químics. Gràcies a la combinació d'aquests tres elements (un equip investigador amb un talent científic excepcional, un enfocament multidisciplinar i tecnologia capdavantera), tenim l'oportunitat de descobrir noves estratègies per al diagnòstic, la prevenció o el tractament de la metàstasi.

Aquests són alguns exemples dels resultats de la nostra recerca:
Una nova eina per universalitzar la medicina personalitzada del càncer
Durant el creixement d’un tumor, les cèl·lules canceroses acumulen alteracions (mutacions) en el seu genoma. El nostre laboratori de Genòmica Biomèdica, liderat per la Dra. Núria López-Bigas, ha desenvolupat una eina computacional (el “Cancer Genome Interpreter”, CGI) basada en l’aprenentatge automàtic, que permet identificar quines d’aquestes mutacions són importants per a la progressió del tumor i quines poden estar relacionades amb la resposta a la teràpia.
El CGI té per finalitat que els metges puguin pautar el tractament més adequat per a cada pacient. Actualment, l’IRB Barcelona col·labora amb diferents entitats a nivell europeu (associacions de pacients, hospitals i altres centres de recerca), amb l’objectiu d’implementar aquesta eina de medicina personalitzada en els sistemes de salut.

Un test per predir el risc de metàstasi òssia en pacients de càncer de mama
Aproximadament 1 de cada 8 dones desenvoluparà càncer de mama al llarg de la vida i, en un 15% d'aquestes casos, el càncer s'estendrà als ossos. Tot i que el càncer de mama té una ràtio de supervivència elevada (de prop del 85%), el pronòstic empitjora considerablement en els casos de metàstasi.
El grup de recerca de Control del Creixement i Metàstasi del Càncer, liderat pel Dr. Roger Gomis, ha identificat un gen (MAF) que és clau en el desenvolupament i, més concretament, en la disseminació de les cèl·lules canceroses als ossos. A partir d’aquest descobriment, l’empresa Inbiomotion, spin-off de l'IRB Barcelona fundada pel Dr. Roger Gomis, ha creat un test (MAF test®) que prediu la probabilitat que té una pacient de càncer de mama de desenvolupar metàstasi als ossos anys després d’haver patit la malaltia i que, alhora, determina si aquesta persona es podria beneficiar d'un tractament adjuvant (potenciador) de la quimioteràpia per prevenir-ne la recaiguda. Ara es treballa perquè el MAF test® s'incorpori a la pràctica clínica i sigui d'ús comú en els hospitals o centres mèdics.

Fàrmacs que bloquegen el consum de greixos per tractar la metàstasi
El laboratori de Cèl·lules Mare i Càncer, dirigit pel Dr. Salvador Aznar-Benitah a l’IRB Barcelona, ha descobert que una proteïna anomenada CD36 és determinant perquè les cèl·lules canceroses siguin metastàtiques.
CD36 es troba a les membranes de les cèl·lules tumorals i s'encarrega de capturar i internalitzar els àcids grassos. Utilitzant models animals de laboratori, els investigadors han observat que quan bloquegen CD36 poden prevenir la formació de metàstasis o reduir de forma dràstica aquelles que ja estan formades. Aquests resultats s’han comprovat en diferents tipus de carcinomes (orals, de mama, de pulmó, d’ovari, de bufeta i melanoma) i demostren que hi ha una relació directa entre el consum de greixos (concretament, d’àcid palmític) i la potenciació de la metàstasi a través de CD36.
Arran d’aquests resultats, l’IRB Barcelona i la Institució de Recerca i Estudis Avançats (ICREA) han fundat l’empresa Ona Therapeutics, que se centra en descobrir medicaments per al tractament del càncer metastàtic.
Teràpies experimentals basades en immunoteràpia per al tractament del càncer colorectal avançat
La immunoteràpia és una tècnica que consisteix a millorar el sistema immunitari per ajudar el cos a eliminar les cèl·lules canceroses. Aquesta tècnica s'ha convertit en poc temps en una arma molt eficaç per tractar alguns tumors com el melanoma o el càncer de pulmó. No obstant això, la majoria dels tumors de còlon no responen a aquest tipus de tractament.
El laboratori de Càncer Colorectal, liderat pel Dr. Eduard Batlle, ha descobert que l'hormona TGF-beta és la responsable de que el sistema immunitari no reconegui ni elimini les cèl·lules tumorals de còlon. Utilitzant models animals, l’equip investigador ha demostrat que la combinació d’un anticòs que bloqueja TGF-beta amb immunoteràpies ja disponibles aconsegueix eliminar metàstasis establertes que, d’altra manera, causarien la mort.
El grup del Dr. Batlle també ha identificat per primera vegada les cèl·lules responsables de que el càncer colorectal reaparegui en forma de metàstasi després que el tumor primari hagi estat operat. Aquestes cèl·lules tumorals residuals, que s’oculten al fetge i al pulmó i que són invisibles als mètodes de detecció disponibles, es poden eliminar mitjançant un tractament amb immunoteràpia previ a la cirurgia.
Aquests descobriments obren vies per al desenvolupament de noves teràpies dirigides específicament a eliminar la malaltia residual o avançada, així com de noves eines diagnòstiques per identificar aquells pacients amb més risc de recaiguda.
Degradació dirigida de proteïnes com a eina terapèutica
El grup de Degradació Dirigida de Proteïnes i Descobriment de Fàrmacs, dirigit per la Dra. Cristina Mayor-Ruiz, aplica la tècnica de l'eliminació (degradació) dirigida de proteïnes a l'estudi molecular del càncer i a la descoberta de nous enfocaments terapèutics.
Actualment, al voltant del 80% de totes les proteïnes del nostre cos queden fora de l'abast dels fàrmacs tradicionals. L'objectiu del laboratori de la Dra. Mayor-Ruiz és sistematitzar el descobriment i la generació de nous fàrmacs degradadors de proteïnes que contribueixen a la multiplicació de les cèl·lules del càncer per oferir, així, més oportunitats de tractament.

Per donar suport a aquesta nova línia d'investigació, l'IRB Barcelona ha posat en funcionament una unitat de descobriment de fàrmacs (Plataforma de Cribratge de Fàrmacs), en una aposta clara per accelerar l'arribada de la recerca a la pràctica clínica.
El laboratori de la Dra. Cristina Mayor-Ruiz és un clar exemple de nous laboratoris que estan desenvolupant projectes en les àrees més prometedores de la recerca oncològica. Aquest progrés ha estat possible gràcies a la confiança de les persones i entitats que ens donen suport.
Descàrrega l'ebook ‘Metàstasi: preguntes i respostes’
Vols rebre el llibre digital 'Metàstasi: preguntes i respostes'? Emplena el següent formulari.
Fes la teva donació per al Repte Metàstasi
4.884.357,99 €
Aconseguit
5.000.000 €
Objectiu
Quant desgraven les donacions?

*Els primers 250€ que donis tindran una desgravació del 100%
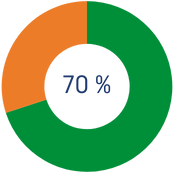
*Et desgravaràs un 70% de l'import que excedeix els 250€.
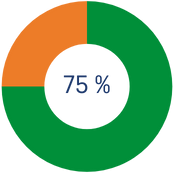
*Si és el 3r any o més que dones a l’IRB Barcelona amb una quantitat igual o superiora l'any anterior, la desgravació per l'import que excedeix els primers 250€ s'incrementa al 75%.
Testimonis del Repte Metàstasi
Pacients
Altres maneres de sumar-te al Repte Metàstasi
Organitza la teva pròpia "Missió: Possible”
#RepteMetàstasi
Ets esportista? Fas manualitats? Et cases? La teva empresa, escola o club fa una festa? ...i vols contribuir a frenar la metàstasi? Crea aquí la teva campanya i ajuda'ns a arribar molt lluny. I, si encara estàs donant-li voltes, pots donar suport a altres iniciatives que ja estan en marxa.
Últimes notícies de Repte Metàstasi
Col·laboren amb el Repte Metàstasi