Images
La malaltia de Kennedy és un trastorn neuromuscular sense tractament considerat una malaltia minoritària
Un estudi dirigit per Xavier Salvatella pot obrir el camí a noves línies de tractament de la malaltia de Kennedy
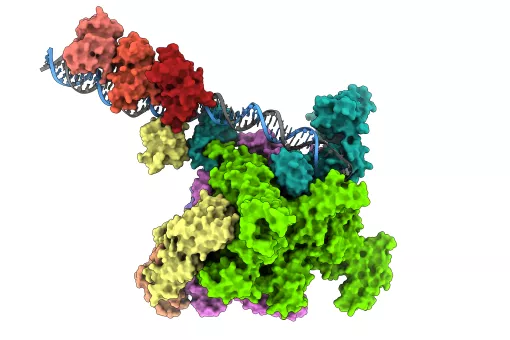
La malaltia de Kennedy és una malaltia neuromuscular minoritària causada per una mutació de la proteïna receptora d’andrògens. El Laboratori de Biofísica Molecular dirigit per Xavier Salvatella a l’Institut de Recerca Biomèdica (IRB Barcelona) ha descobert recentment noves característiques estructurals claus del receptor androgènic induïdes per la mutació. Aquestes conclusions s’han publicat a la revista Nature Communicationsi podrien obrir noves vies terapèutiques per a una família de malalties rares incurables anomenades malalties d’expansió de poliglutamina (polyQ).
L’atròfia muscular bulboespinal (SBMA), també coneguda com malaltia de Kennedy, és un trastorn neuromuscular sense tractament que causa una minva dràstica de la qualitat de vida dels pacients. Està classificada com a malaltia minoritària, de manera que afecta menys de 5 de cada 10.000 persones. La mutació de la proteïna receptora d’andrògens que causa la malaltia és una expansió d’una seqüència repetitiva d’aminoàcids que conté únicament residus de glutamina, anomenada tracte polyQ. Curiosament, la longitud d’aquest tracte determina si una persona desenvolupa la malaltia de Kennedy.
També es pot trobar una mutació similar en altres malalties d’expansió de polyQ, la més coneguda de les quals és la malaltia de Huntington. Es desconeixen els motius pels quals una expansió del tracte polyQ condueix al desenvolupament de malalties d’expansió de polyQ. En el cas de la malaltia de Kennedy, els investigadors creuen que les proteïnes receptores d’andrògens que contenen una poliglutamina molt llarga tendeixen a oligomeritzar. Aquests oligòmers generen aleshores agregats de proteïnes tòxiques a l’interior de la cèl·lula, fet que n’impedeix el bon funcionament.
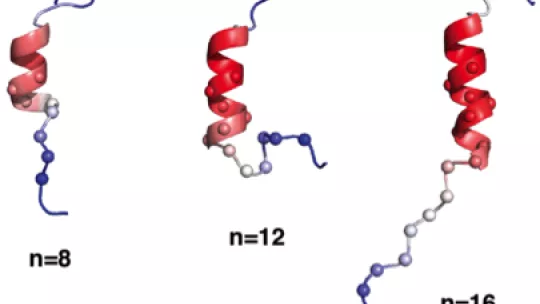
Perquè una proteïna funcioni correctament, ha de plegar-se en una estructura tridimensional ordenada. Fins ara, es creia que la part de la proteïna receptora d’andrògens que contenia l’expansió de polyQ era desordenada i, per tant, no es podia plegar en aquesta estructura. El 2016, el grup de Salvatella va descobrir que el tracte polyQ del receptor androgènic podia adoptar una estructura helicoïdal. “Va ser una conclusió molt interessant, ja que fins ara es creia que aquests tractes no adopten cap estructura específica”, explica Salvatella.
En l’estudi actual, l’equip va fer un pas més enllà i va visualitzar l’hèlix de la proteïna del tracte polyQ mitjançant mètodes biofísics i computacionals avançats. Ara informen que aquesta regió específica pot formar hèlixs ben ordenades i, fonamentalment, que l’expansió de polyQ augmenta considerablement el grau d’ordre i estabilitat d’aquestes hèlixs. Aquesta informació amplia la nostra comprensió de la funció dels receptors androgènics.
Albert Escobedo, investigador postdoctoral de l’IRB Barcelona i primer coautor de l’estudi, diu: “Les nostres conclusions indiquen que els tractes polyQ llargs mutats poden formar hèlixs cada vegada més estables. Aquest fet suggereix que poden causar trastorns de poliglutamina com ara la malaltia de Kennedy.” Destaca que “atacar aquestes hèlixs amb fàrmacs pot ser una via terapèutica per a aquests trastorns actualment sense cura”.
Aquest estudi s’ha finançat amb subvencions de la Marató de TV3, el Consell Europeu de Recerca (ERC) i el Ministeri de Ciència, Innovació i Universitats (anteriorment conegut com MINECO).
Article de referència:
Albert Escobedo, Busra Topal, Micha B. A. Kunze, Juan Aranda, Giulio Chiesa, Daniele Mungianu, Ganeko Bernardo-Seisdedos, Bahareh Eftekharzadeh, Margarida Gairí, Roberta Pierattelli, Isabella C. Felli, Tammo Diercks, Oscar Millet, Jesús García, Modesto Orozco, Ramon Crehuet, Kresten Lindorff-Larsen and Xavier Salvatella.
Side chain to main chain hydrogen bonds stabilize a polyglutamine helix in a transcription factor.
Nature Communications (2019) DOI: 10.1038/s41467-019-09923-2
IRB Barcelona
L’Institut de Recerca Biomèdica (IRB Barcelona) treballa per aconseguir una vida lliure de malalties. Desenvolupa una recerca multidisciplinària d’excel·lència per curar el càncer i altres malalties vinculades a l'envelliment. Treballa establint col·laboracions amb la indústria farmacèutica i els principals hospitals per fer arribar els resultats de la recerca a la societat a través de la transferència de tecnologia, i du a terme diferents iniciatives de divulgació científica per mantenir un diàleg obert amb la ciutadania. L’IRB Barcelona és un centre internacional que acull al voltant de 400 investigadors de més de 30 nacionalitats. Reconegut com a Centre d'Excel·lència Severo Ochoa des de 2011, és un centre CERCA i membre del Barcelona Institute of Science and Technology (BIST).